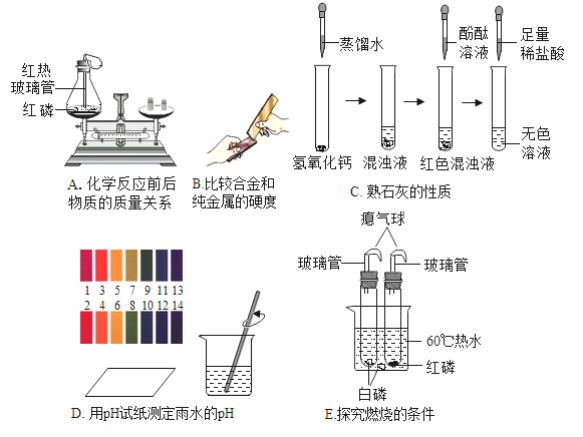
题目内容
【题目】将100g氯化钾样品(含有碳酸钾杂质)加入到50g盐酸中,样品完全反应,产生的气体全部逸出,并测得反应后的溶液总质量为145.6g。
请计算:
(1)K2CO3中K、C、O元素的质量比为__。
(2)产生气体的质量为____g;
(3)样品中氯化钾的质量分数___________。(写出计算过程,最后结果精确到0.1%)
【答案】13:2:8。4.4;86.2%
【解析】
根据碳酸钾的化学式求算对应的元素质量比。根据质量守恒可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算样品中氯化钾的质量分数。
(1)K2CO3中K、C、O元素的质量比(39×2):12:(16×3)=13:2:8;
(2)根据质量守恒定律可得,生成的二氧化碳的质量为100g+50g﹣145.6g=4.4g
(3)设:生成4.4g的二氧化碳需要碳酸钾的质量为x。
K2CO3+2HCl═2KCl+H2O+CO2↑
138 44
x 4.4g
![]() x=13.8g
x=13.8g
样品中氯化钾的质量=100g-13.8g=86.2g
样品中氯化钾的质量分数=![]() ×100%=86.2%
×100%=86.2%
答:(1)K2CO3中K、C、O元素的质量比为 13:2:8;
(2)产生气体的质量为 4.4g;
(3)品中氯化钾的质量分数为86.2%。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目