题目内容
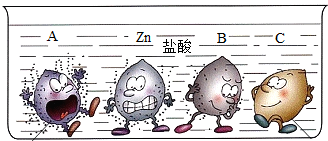
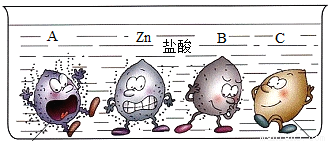
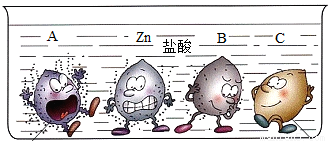
四支试管中分别盛有相同质量分数的稀盐酸,将A、B、C和锌四种金属分别同时放入其中,小明将观察到的现象形象的画了一幅卡通画,每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体.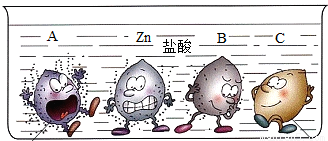
(1)A、B、C三种金属的活泼性由强到弱的顺序可能是______.
(2)B是常见的金属,请写出该金属和盐酸反应的化学方程式______.
【答案】分析:根据图片中四种金属表面气泡及量的多少,判断金属与酸反应的剧烈程度,由此判断金属的活动性;结合金属活动性顺序表和反应规律书写化学方程式.
解答:解:(1)图中金属A表面气泡最多,其次为金属锌,最少的为金属B,金属C表面无气泡,所以A、B、C三种金属活动性由强到弱的顺序为:A>B>C;
故选A>B>C;
(2)金属B表面气泡比金属锌少,说明金属B与盐酸反应不如金属锌剧烈,则金属B的活动性比锌弱;根据金属活动性顺序表:能与酸发生放出氢气且活动性小于锌的金属有Fe、Sn、Pb三种,根据“B是常见的金属”,B为金属铁;
故答案为:Fe+2HCl═FeCl2+H2↑.
点评:金属活动顺序表中,位于H之前的金属可以与酸反应放出氢气,位于H之后的金属不能与酸发生置换反应.
解答:解:(1)图中金属A表面气泡最多,其次为金属锌,最少的为金属B,金属C表面无气泡,所以A、B、C三种金属活动性由强到弱的顺序为:A>B>C;
故选A>B>C;
(2)金属B表面气泡比金属锌少,说明金属B与盐酸反应不如金属锌剧烈,则金属B的活动性比锌弱;根据金属活动性顺序表:能与酸发生放出氢气且活动性小于锌的金属有Fe、Sn、Pb三种,根据“B是常见的金属”,B为金属铁;
故答案为:Fe+2HCl═FeCl2+H2↑.
点评:金属活动顺序表中,位于H之前的金属可以与酸反应放出氢气,位于H之后的金属不能与酸发生置换反应.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
 21、四支试管中分别盛有相同质量分数的稀盐酸,将A、B、C和锌四种金属分别同时放入其中,小明将观察到的现象形象的画了一幅卡通画,每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体.
21、四支试管中分别盛有相同质量分数的稀盐酸,将A、B、C和锌四种金属分别同时放入其中,小明将观察到的现象形象的画了一幅卡通画,每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体.