题目内容
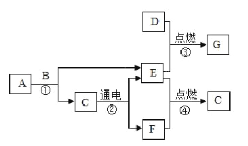
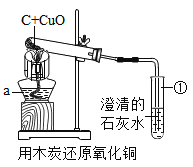
【题目】菁菁同学设计如图所示装置进行实验,目的是探究木炭和氧化铜在高温条件下生成的气体产物,提出了如下两种猜想:a.可能是二氧化碳;b.可能是一氧化碳。预期的实验现象及结论如下:
Ⅰ.若澄清石灰水变浑浊,则气体为二氧化碳;
Ⅱ.若澄清石灰水不变浑浊,则气体为一氧化碳。
{查阅资料]:
(1)氢氧化钙和氢氧化钠在物质类别上都属于碱;
(2)CO2能与碱发生反应:如2NaOH + CO2 = Na2CO3 + H2O(此反应常用于吸收二氧化碳).
请你分析并回答:
(1)仪器a的名称为___________,
(2)菁菁同学的实验装置存在的缺陷是________;反应结束时,停止实验的操作步骤是_______;
(3)实验后发现试管①内壁上附着不易用试管刷洗净的固体生成物,可在试管①中加入足量的_____进行清洗。
(4)你认为菁菁同学的猜想是否严谨?____,理由是:_____________________ 。
(5)请设计一个实验,来验证你的理由。操作过程、现象和结论写出:____________________。
【答案】酒精灯 没有尾气处理装置 先将导管从石灰水中移出,再熄灭酒精灯 稀盐酸 不严谨 气体产物可能是 CO和 CO2的混合物 先将气体产物依次通入澄清石灰水,足量 NaOH溶液,再通过盛装 CuO的硬质玻璃管加热, 观察现象,若石灰水变浑浊且CuO变红则猜想正确
【解析】
(1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据一氧化碳有毒,需要尾气处理,反应结束时,停止实验的操作步骤是先将导管从石灰水中移出,再熄灭酒精灯,防止石灰水倒流,炸裂试管进行分析;
(3)根据实验后发现试管①内壁上附着不易用试管刷洗净的固休生成物,该物质是反应生成的碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
(4)根据碳和二氧化碳在高温的条件下会生成一氧化碳进行分析;
(5)根据二氧化碳能使澄清石灰话变浑浊,一氧化碳具有还原性进行分析。
(1)通过分析题中所指仪器的名称和作用可知,a是酒精灯;
(2)一氧化碳有毒,需要尾气处理,所以实验装置存在的缺陷是没有尾气处理装置,反应结束时,停止实验的操作步骤是先将导管从石灰水中移出,再熄灭酒精灯,防止石灰水倒流,炸裂试管;
(3)实验后发现试管①内壁上附着不易用试管刷洗净的固休生成物,该物质是反应生成的碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,所以可在试管①中加入足量的稀盐酸进行清洗;
(4)碳和二氧化碳在高温的条件下会生成一氧化碳,所以菁菁同学的猜想不严谨,原因是:气体产物可能是CO和CO2的混合物;
(5)二氧化碳能使澄清石灰话变浑浊,一氧化碳具有还原性,所以设计的实验操作过程、现象和结论是:先将气体产物依次通入澄清石灰水,足量NaOH溶液,再通过盛装CuO的硬质玻璃管加热,观察现象,若石灰水变浑浊且CuO变红则猜想正确。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
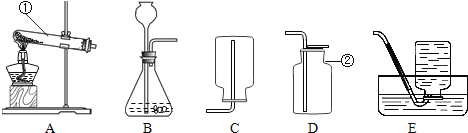
期末集结号系列答案【题目】小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V。 (实验中操作正确,O2的密度为ρg/cm3)
实验序号 | 1 | 2 | 3 |
m1(MnO2)/g | |||
m2(KClO3)/g | |||
m3(试管)/g | |||
m4(试管+加热后剩余固体)/g | |||
量筒内收集气体的体积V/cm3 |

(1)实验前应检查装置的__________,二氧化锰在该反应中的作用是________.
(2)根据质量守恒定律,m1、m2、m3、m4与V和ρ之间应存在的等量关系为_________。
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的MnO2分离并测量其质量,发现总小于加热前MnO2的质量。查阅资料后发现,一般认为加热KC103和MnO2混合物的反应过程如下:(请补全第2步的化学方程式)
第1步:2MnO2+2KClO3![]() 2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第2步:__________;
第3步:K2MnO4+Cl2![]() 2KCl+MnO2+O2↑
2KCl+MnO2+O2↑
根据反应过程分析,加热后剩余固体中MnO2质量总小于加热前MnO2质量的原因是:______。
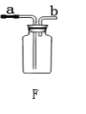
【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见的氧化物和一种气体。小梅很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。

⑴试管尾部放一团棉花的目的是_______________
⑵探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。
⑶探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
FeO+2HCl=FeCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O Fe3O4+8HCl=2FeCl2+FeCl3+4H2O
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想一:剩余固体是Fe与Fe3O4 ;猜想二:剩余固体是_________________。
(实验探究)
实验操作 | 实验现象及结论 |
向试管中加入_________ | 若_________。则猜想二正确,猜想一不正确。 |
(实验结论)根据⑵和⑶,铁和水蒸气在高温下反应的产物为______________。