题目内容
【题目】如图所示,是为了验证稀硫酸化学性质所做的三个实验,回答下列问题.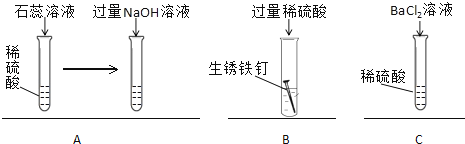
(1)A实验最终能观察到的现象是;
(2)B实验能体现出稀硫酸具有的化学性质是;
(3)C实验中发生反应的化学方程式为;
(4)将上述实验后所得溶液在烧杯中混合,观察到烧杯底部有沉淀,上层为有色溶液,此时,利用烧杯中的沉淀,再选择适当的试剂,即可证明C实验中所加BaCl2溶液过量,实验的操作及现象是 .
【答案】
(1)溶液变蓝
(2)能与金属氧化物和金属反应
(3)H2SO4+BaCl2═BaSO4↓+2HCl
(4)与C混合后,沉淀的质量增加,则证明实验中所加BaCl2溶液过量
【解析】解:(1)氢氧化钠过量,溶液呈碱性,石蕊显蓝色;(2)铁锈的主要成分是氧化铁,是金属氧化物,与硫酸反应生成硫酸铁和水,被硫酸反应完后,里面的铁继续与硫酸反应生成硫酸亚铁和氢气;(3)氯化钡与硫酸反应生成硫酸钡沉淀和氯化氢,化学方程式为:H2SO4+BaCl2═BaSO4↓+2HCl;(4)AB试验中的产物中均含有硫酸根,若与C混合后,沉淀的质量增加,则证明实验中所加BaCl2溶液过量
所以答案是:(1)溶液变蓝;(2)能与金属氧化物和金属反应;(3)H2SO4+BaCl2═BaSO4↓+2HCl;(4)与C混合后,沉淀的质量增加,则证明实验中所加BaCl2溶液过量
【考点精析】利用书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号.

练习册系列答案
相关题目