题目内容
某学校化学兴趣小组拟通过实验来验证质量守恒定律并着重进行后续实验,请你参与其中.
(1)他们把一定量的铁粉放入盛有硫酸铜溶液的烧杯中,发现反应前后物质的总质量不变.请你用原子的观点帮他们解释“守恒”的原因:______.
(2)充分反应后,他们把烧杯中的物质进行过滤,得到滤渣和滤液.把滤渣洗涤,干燥,称量,发现滤渣质量比加入的铁粉质量大,原因是:反应溶解的铁的质量______(填“小于”、“等于”或“大于”)反应生成的铜的质量.该实验除验证了质量守恒定律外,还能得出金属铁的活动性比铜的活动性______(“弱”或“强”).
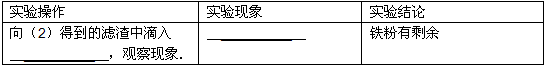
(3)若想继续探究铁粉是否完全反应,请你帮他们填写下表:
| 实验操作 | 实验现象 | 实验结论 |
| 向(2)得到的滤渣中滴入 ______,观察现象. | ______ | 铁粉有剩余 |
解:(1)在化学反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化,所以反应前后物质的总质量不变;
(2)铁与硫酸铜反应生成硫酸亚铁和铜,其化学方程式为:Fe+CuSO4═FeSO4+Cu,即铁被铜所替代,而它们在和硫酸根结合时都是正二价的离子,根据铁的相对原子质量为56,铜的相对原子质量为64,可以判断滤渣质量增加了;
(3)验证铁是否完全反应可以根据铁能够跟盐酸或是硫酸反应生成气体,而铜不能的原理来检验;
故答案为:(1)化学反应中原子的种类、个数、质量不变;
(2)小于;强;
(3)
| 实验操作 | 实验现象 | 实验结论 |
| 向(2)得到的滤渣中滴入 稀盐酸(或稀硫酸),观察现象. | 有气泡产生,溶液逐渐变浅绿色. | 铁粉有剩余 |
分析:(1)通过质量守恒定律的实质来解释反应前后物质的总质量不变的原因:根据化学反应的实质可知,分子分成原子,原子结合成新的分子,所以原子的种类、数目、质量都不变;
(2)根据用铁的相对原子量比同铜的小,并结合化学方程式来判断质量改变的大小;
(3)根据铁的性质来设计实验进行验证.
点评:熟练掌握金属活动顺序,能够根据金属活动顺序结合反应来判断溶液的质量增减情况,熟记化学方程式:Fe+CuSO4═FeSO4+Cu.

练习册系列答案
相关题目
(2009?顺德区模拟)某学校化学兴趣小组拟通过实验来验证质量守恒定律并着重进行后续实验,请你参与其中.
(1)他们把一定量的铁粉放入盛有硫酸铜溶液的烧杯中,发现反应前后物质的总质量不变.请你用原子的观点帮他们解释“守恒”的原因:______.
(2)充分反应后,他们把烧杯中的物质进行过滤,得到滤渣和滤液.把滤渣洗涤,干燥,称量,发现滤渣质量比加入的铁粉质量大,原因是:反应溶解的铁的质量______(填“小于”、“等于”或“大于”)反应生成的铜的质量.该实验除验证了质量守恒定律外,还能得出金属铁的活动性比铜的活动性______(“弱”或“强”).
(3)若想继续探究铁粉是否完全反应,请你帮他们填写下表:
(1)他们把一定量的铁粉放入盛有硫酸铜溶液的烧杯中,发现反应前后物质的总质量不变.请你用原子的观点帮他们解释“守恒”的原因:______.
(2)充分反应后,他们把烧杯中的物质进行过滤,得到滤渣和滤液.把滤渣洗涤,干燥,称量,发现滤渣质量比加入的铁粉质量大,原因是:反应溶解的铁的质量______(填“小于”、“等于”或“大于”)反应生成的铜的质量.该实验除验证了质量守恒定律外,还能得出金属铁的活动性比铜的活动性______(“弱”或“强”).
(3)若想继续探究铁粉是否完全反应,请你帮他们填写下表:
| 实验操作 | 实验现象 | 实验结论 |
| 向(2)得到的滤渣中滴入 ______,观察现象. | ______ | 铁粉有剩余 |