题目内容
(2011年广东广州,27题)从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________
②过滤操作需用到的玻璃仪器除烧杯外,还有__________________________。
(2)制各氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作.盐酸不宜过量
①反应的化学方程式是_____________________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解5.8gMg(OH)2需要36. 5%HCl溶液
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到
到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,___________________________
直到Mg(OH)2完全溶解为止。
(3)制各氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________
②过滤操作需用到的玻璃仪器除烧杯外,还有__________________________。
(2)制各氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作.盐酸不宜过量
①反应的化学方程式是_____________________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解5.8gMg(OH)2需要36. 5%HCl溶液
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到
到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,___________________________
直到Mg(OH)2完全溶解为止。
(3)制各氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶
⑴① CaO+H2O=Ca (OH)2 ②漏斗、玻璃棒
⑵① Mg(OH)2+2HCl=MgCl2+2H2O
②20 ③用胶头滴管逐滴加入稀盐酸溶液

⑵① Mg(OH)2+2HCl=MgCl2+2H2O
②20 ③用胶头滴管逐滴加入稀盐酸溶液
试题分析::(1)①氧化钙和水反应能够放出大量的热,反应的化学方程式为:CaO+H2O=Ca(OH)2,
②过滤操作需用到的玻璃仪器除烧杯外,还有漏斗、玻璃棒,故填:漏斗、玻璃棒,
(2)①盐酸和氢氧化镁反应的化学方程式是:Mg(OH)2+2HCl=MgCl2+2H2O,
②解设溶解5.8gMg(OH)2需要氯化氢的质量为X,
Mg(OH)2+2HCl=MgCl2+2H2O
58 73
5.8g X
58/73=5.8/x
X=7.3g
需要36.5%HCl溶液的质量为:7.3g÷36.5%=20g,
答:需要36.5%HCl溶液的质量为20g,
③操作是:将Mg(OH)2加入烧杯中,用胶头滴管逐滴加入稀盐酸溶液直到Mg(OH)2完全溶解为止.故填:用胶头滴管逐滴加入稀盐酸溶液。
点评:解答本题要掌握化学方程式的书写方法,理解过滤操作,能够根据化学方程式进行相关方面的计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
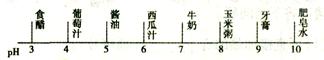
 表示人体内的一些体液和排泄物的正常PH范围,据此判断其中酸性最强的是:
表示人体内的一些体液和排泄物的正常PH范围,据此判断其中酸性最强的是: