题目内容
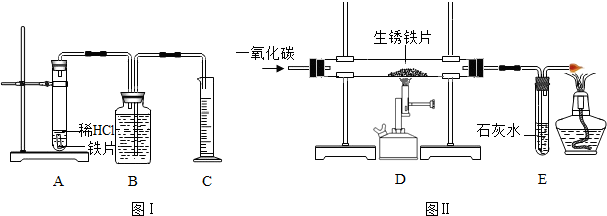
为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案.
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.
(1)称量是,应将铁片放在托盘天平的______盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为
2.12g、2.1g,其中不合理的数据是______.
(2)评价交流:上述两个方案中,可行的是______(填“甲”或“乙”);分析不可行方案,其缺陷是______.
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
| 实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
① 装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性;反应结束后,还要继续通CO至室温的目的是______ 化学方程式:______ |
| ② 装置Ⅰ | 将光亮铁片放入稀盐酸中,完全反应 | 溶液颜色由无色变成浅绿色,有气泡放出 | 化学方程式:______ |
(5)结论:生锈铁片中铁元素的质量分数是______(用字母表示)
解:(1)用托盘天平称量物质,应该是左物右码,而且托盘天平的读数精确到小数点后一位,故答案为:左,2.12
(2)由于生锈铁片中除了铁、铁的化合物之外还含有水分等不含铁元素的物质,由于方案甲中根据计算只能得出铁片中金属铁的质量,而无法知道铁的化合物的质量,故答案为:乙,不能测出生锈铁片中铁元素的质量
(3)①由于一氧化碳具有还原性,因此常用来冶炼金属,当实验结束时,要继续通一氧化碳,主要是因为玻璃管冷却会导致里面的压强减小,从而试管内的水会倒吸到玻璃管内,故答案为:还原性,防止水倒吸,Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
②由于铁能够和稀盐酸反应生成氢气,故答案为:Fe+2HCl=FeCl2+H2↑
(4)由于二氧化碳是造成温室效应的主要气体,而一氧化碳有毒,排放到空气中会造成空气污染,因此必须对这两种气体进行处理,故答案为:将E中的水改成澄清石灰水或氢氧化钠溶液,并在E的导出管口处点燃导出的气体
(5)根据质量守恒定律可知,和稀盐酸反应的铁的质量即为生锈铁片中铁元素的质量,可设生锈铁片中铁元素的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x p2V2
 =
=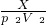
x= =28p2V2
=28p2V2
则生锈铁片中铁元素的质量分数为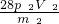 ×100%=
×100%=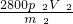 %,故答案为:
%,故答案为: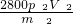 %
%
分析:由于生锈铁片中除了铁、铁的化合物之外还含有水分等不含铁元素的物质,由于方案甲中根据计算只能得出铁片中金属铁的质量,无法计算出铁的氧化物的质量,也就无法计算出铁元素的总质量;而乙首先利用还原剂把铁的化合物中的铁元素全部变成了金属铁,然后根据生成的氢气的质量就可求出参与反应的金属铁的质量即生锈铁片中铁元素的总质量.
点评:本题难度较大,主要考查了铁的冶炼、铁的有关化学性质及质量守恒定律的应用,培养学生的分析问题、解决问题的能力.
(2)由于生锈铁片中除了铁、铁的化合物之外还含有水分等不含铁元素的物质,由于方案甲中根据计算只能得出铁片中金属铁的质量,而无法知道铁的化合物的质量,故答案为:乙,不能测出生锈铁片中铁元素的质量
(3)①由于一氧化碳具有还原性,因此常用来冶炼金属,当实验结束时,要继续通一氧化碳,主要是因为玻璃管冷却会导致里面的压强减小,从而试管内的水会倒吸到玻璃管内,故答案为:还原性,防止水倒吸,Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2②由于铁能够和稀盐酸反应生成氢气,故答案为:Fe+2HCl=FeCl2+H2↑
(4)由于二氧化碳是造成温室效应的主要气体,而一氧化碳有毒,排放到空气中会造成空气污染,因此必须对这两种气体进行处理,故答案为:将E中的水改成澄清石灰水或氢氧化钠溶液,并在E的导出管口处点燃导出的气体
(5)根据质量守恒定律可知,和稀盐酸反应的铁的质量即为生锈铁片中铁元素的质量,可设生锈铁片中铁元素的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x p2V2
 =
=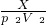
x=
 =28p2V2
=28p2V2则生锈铁片中铁元素的质量分数为
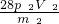 ×100%=
×100%=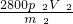 %,故答案为:
%,故答案为: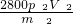 %
%分析:由于生锈铁片中除了铁、铁的化合物之外还含有水分等不含铁元素的物质,由于方案甲中根据计算只能得出铁片中金属铁的质量,无法计算出铁的氧化物的质量,也就无法计算出铁元素的总质量;而乙首先利用还原剂把铁的化合物中的铁元素全部变成了金属铁,然后根据生成的氢气的质量就可求出参与反应的金属铁的质量即生锈铁片中铁元素的总质量.
点评:本题难度较大,主要考查了铁的冶炼、铁的有关化学性质及质量守恒定律的应用,培养学生的分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
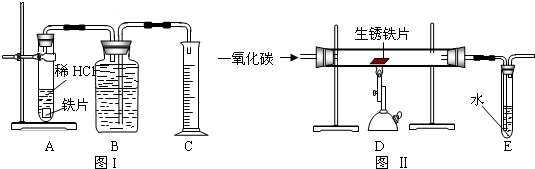
为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案.
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.
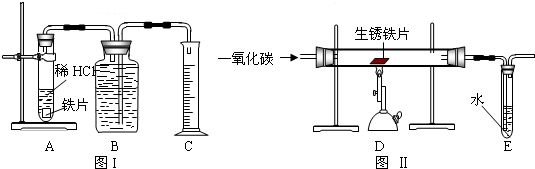
(1)称量是,应将铁片放在托盘天平的 盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为
2.12g、2.1g,其中不合理的数据是 .
(2)评价交流:上述两个方案中,可行的是 (填“甲”或“乙”);分析不可行方案,其缺陷是 .
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
(4)提出问题:图II所示装置是否有可改进之处?请简要叙述具体改进意见,或在图II中画出简易装置示意图.
(5)结论:生锈铁片中铁元素的质量分数是 (用字母表示)
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.

(1)称量是,应将铁片放在托盘天平的
2.12g、2.1g,其中不合理的数据是
(2)评价交流:上述两个方案中,可行的是
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
| 实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
① 装置Ⅱ |
通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 |
CO具有 化学方程式: |
| ② 装置Ⅰ |
将光亮铁片放入稀盐酸中,完全反应 | 溶液颜色由无色变成浅绿色,有气泡放出 | 化学方程式: |
(5)结论:生锈铁片中铁元素的质量分数是
为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案.
方案甲:称得生锈铁片的质量为m1g,按图I所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为p1g/L.
方案乙:称得生锈铁片的质量为m2g,先按图II所示装置进行实验.充分反应后,停止加热,继续通入CO至室温.将得到的铁,按图I所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为p1g/L.
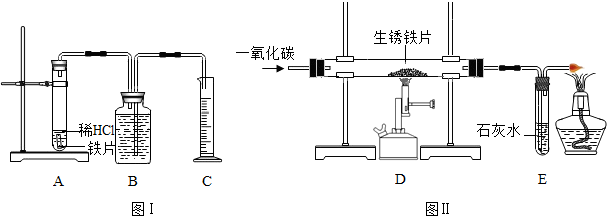
【查阅资料】假设铁锈的杂质中不含铁元素.
【评价交流】上述两个方案中,可行的是方案________(填“甲”或“乙”);分析不可行方案,其缺陷是________.
【设计实验】方案乙中,同学们设计了如下实验报告,请帮助完成.
| 试验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
| ①装置II | 通入CO加热,完全反应后,停止加热,继续通入CO至室温 | 生锈铁片变成光亮的银白色 | CO具有________性,化学方程式为________ |
| ②装置I | 将光亮铁片放入稀盐酸中,完全反应 | 溶液颜色由无色变成浅绿色,有气泡放出 | 化学方程式为 ________ |
【实验结论】生锈铁片中铁元素是质量分数是________%(用字母表示).
(2009?成都)为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案.
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.

(1)称量是,应将铁片放在托盘天平的______盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为
2.12g、2.1g,其中不合理的数据是______.
(2)评价交流:上述两个方案中,可行的是______(填“甲”或“乙”);分析不可行方案,其缺陷是______.
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
2Fe+3CO2
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.

(1)称量是,应将铁片放在托盘天平的______盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为
2.12g、2.1g,其中不合理的数据是______.
(2)评价交流:上述两个方案中,可行的是______(填“甲”或“乙”);分析不可行方案,其缺陷是______.
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
| 实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
① 装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性;反应结束后,还要继续通CO至室温的目的是______ 化学方程式:______ |