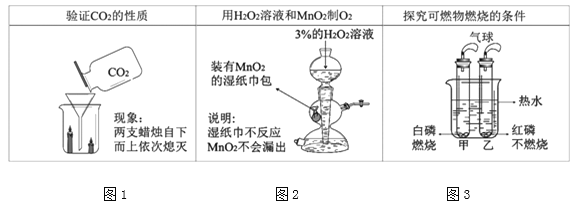
题目内容
【题目】工业上用闪锌矿(主要成分是ZnS、FeS)冶炼锌,主要流程如下:
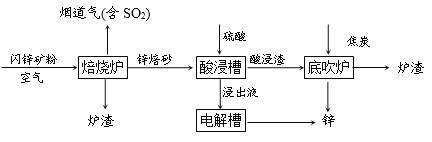
(1)焙烧炉中ZnS转化为ZnO,反应的化学方程式为:____________。
(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的浸出液,反应过程中需不断搅拌,其目的是____________。酸浸渣的主要成分是铁酸锌(ZnFe2O4),其中铁元素的化合价为____________。
(3)底吹炉中可以获得锌,发生的反应主要有:
①3ZnFe2O4+ C![]() 2Fe3O4 +3ZnO+CO
2Fe3O4 +3ZnO+CO
②ZnFe2O4+ CO![]() 2FeO + ZnO+CO2
2FeO + ZnO+CO2
③ZnO+ CO![]() Zn(蒸汽)+CO2
Zn(蒸汽)+CO2
经分析,炉渣中除了Fe3O4、FeO等铁的氧化物外,还含有铁的单质,理由是______________
(4)烟道气中的二氧化硫用石灰石浆吸收以防止污染环境,并获得生产石膏的原料硫酸钙,其反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2。若1000 kg废气中含有1.6 kg二氧化硫,计算这些二氧化硫产生硫酸钙的质量。_______ (写出计算过程)
【答案】2ZnS+ 3O2![]() 2ZnO + 2SO2使硫酸与锌焙砂充分反应,提高转化率+3高温条件下,一氧化碳能与铁的氧化物反应生成铁单质解:设这些二氧化硫可以产生硫酸钙质量为x
2ZnO + 2SO2使硫酸与锌焙砂充分反应,提高转化率+3高温条件下,一氧化碳能与铁的氧化物反应生成铁单质解:设这些二氧化硫可以产生硫酸钙质量为x
2CaCO3+2SO2+O2=2CaSO4+2CO2
128 272
1.6kg x
![]()
x=3.4kg
答:这些二氧化硫可以产生3.4kg硫酸钙。
【解析】(1)焙烧炉中ZnS转化为ZnO,反应的化学方程式为:2ZnS+ 3O2高温2ZnO + 2SO2。
(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的浸出液,反应过程中需不断搅拌,其目的是使硫酸与锌焙砂接触更充分,进而充分反应,提高转化率。酸浸渣的主要成分是铁酸锌(ZnFe2O4),设其中铁元素的化合价为为x,则2x+(+2)+(-2)×4=0 x=+3;(3)炉渣中除了Fe3O4、FeO等铁的氧化物外,还含有铁的单质,理由是一氧化碳或碳在高温下能与铁的氧化物反应,生成单质铁;(4). 设这些二氧化硫可以产生硫酸钙质量为x
2CaCO3+2SO2+O2=2CaSO4+2CO2
128 272
1.6kg x
![]()
x=3.4kg
答:这些二氧化硫可以产生3.4kg硫酸钙。

 阅读快车系列答案
阅读快车系列答案