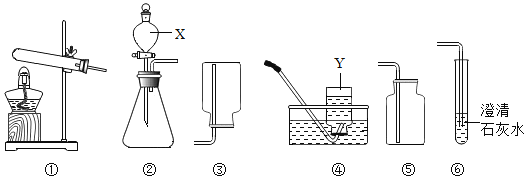题目内容
【题目】下表列出了1-18号元素的原子序数和元素符号:请回答下列问题:
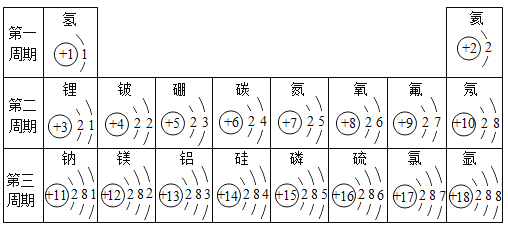
(1)l~18号元素中属于稀有气体元素的有He、Ne、_____(填元素符号).
(2)l~18号元素中最外层有2个电子的原子有_____、Be、Mg(填元素符号).
(3)钠元素位于元素周期表中第_____周期,同一周期,元素具有相同的_____数,_____依次递增.画出钠元素的离子结构示意图为_____。
(4)氯原子在化学反应中一般易_____电子(填“得到”或“失去”),能形成带_____电荷的_____离子(填“阴”或“阳”)离子符号是_____.氯原子与_____(填元素符号)的化学性质相似,因为它们的_____相同。
(5)原子在失去或得到电子变成相应的离子时,一般不会发生改变的有_____(填编号).
A 核内质子数 B 最外层电子数 C 元素的化学性质 D 微粒的电性
(6)元素的种类决定于_____数.
(7)图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图。
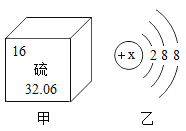
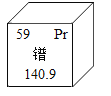
①该元素的原子的核电荷数为_____,相对原子质量为_____。
②图乙中x的值是_____,所示粒子的符号为_____。
【答案】Ar He 三 电子层数 质子数或核电荷数、最外层电子数 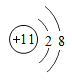 得到 负 阴
得到 负 阴 ![]() F 最外层电子数 A 质子数(核电荷数) 16 32.06 16
F 最外层电子数 A 质子数(核电荷数) 16 32.06 16 ![]()
【解析】
(1)l~18号元素中属于稀有气体元素的有He、Ne、Ar。
(2)l~18号元素中最外层有2个电子的原子有He、Be、Mg。
(3)钠元素位于元素周期表中第三周期,同一周期,元素具有相同的电子层数,质子数或核电荷数、最外层电子数,钠原子失去一个电子形成钠离子,钠离子的结构示意图为 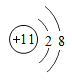 。
。
(4)氯原子最外层电子数为7,在化学反应中一般易得到一个电子,能形成带负电荷的阴离子,离子符号是![]() ,氯原子与氟原子(F)最外层电子数均为7,它们的化学性质相似,因为它们的最外层电子数相同。
,氯原子与氟原子(F)最外层电子数均为7,它们的化学性质相似,因为它们的最外层电子数相同。
(5)原子在失去或得到电子变成相应的离子时,一般不会发生改变的有核内质子数,因为质子数决定元素种类,而最外层电子数、元素的化学性质、微粒的电性均发生改变;
故填:A。
(6)元素的种类决定于质子数(核电荷数)。
(7)①该元素的原子的核电荷数=原子序数=16,相对原子质量为32.06。
②图乙中x的值是该原子的核电荷数=16,乙中粒子为硫离子,符号为![]() 。
。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】空气中氧气含量测定的再认识。
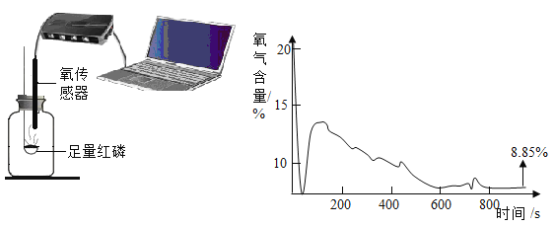
(一)某化学实验小组点燃红磷,并用氧传感器测定空气中的氧气含量并采集数据如上图。
(1)红磷在瓶中燃烧产生的现象是_____,红磷燃烧的化学方程式是_____。
(2)开始时氧气的含量持续下降,一方面是氧气被消耗,另一方面是生成物大量和氧传感器接触,但在110s时氧气的含量又有所上升,其可能原因是_____。
(3)从以上数据分析最终集气瓶中的氧气是否完全消耗_____。
(二)针对以上实验测定结果实验小组同学对该实验做了以下两种改进:

Ⅰ.根据铁在空气中生锈的原理设计如图实验装置,测定空气中氧气含量。
查资料:装置中饱和食盐水、活性炭会加速铁生锈。
测得实验数据如下表:
测量项目 | 实 验 前 | 实 验 后(冷却到室温后) | ||
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)的容积 | 导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 | 6.0 |
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式_____;该反应的基本类型是_____。
(2)根据上表数据计算,改进实验后测得的空气中氧气的体积分数是_____%(结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是:
①_____;②_____。
Ⅱ.将足量白磷放在集气瓶中,白磷能发生缓慢氧化从而消耗氧气,并用压强传感器测定瓶中压强的变化,根据压强的变化来计算空气中氧气的含量,实验装置及数据采集如下图。
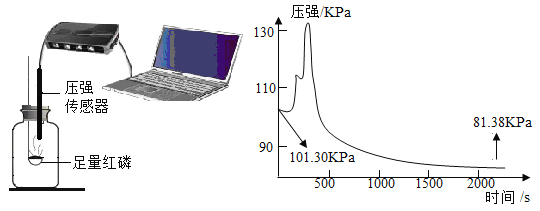
(1)在开始200s压强增大,增大的原因是_____。
(2)用上图所示数据计算用这种方法测得的空气中氧气的体积分数是_____%(结果精确到0.1%)。
(三)结论:测定空气中氧气含量用燃烧法测定结果误差较大,用缓慢氧化误差较小。
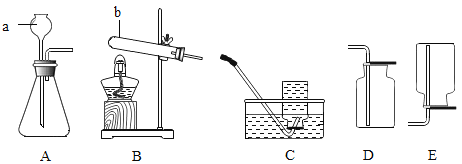
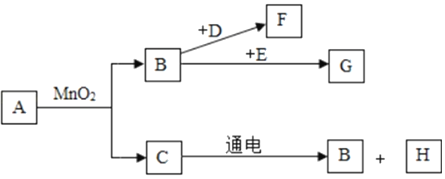
【题目】化学是一门以实验为基础的科学。请根据下列仪器和实验装置回答有关问题:
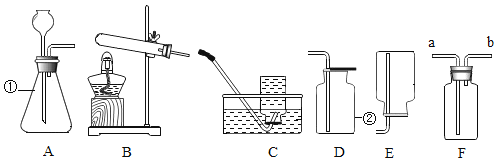
(1)写出标号仪器的名称:①________;②________;
(2)若选择高锰酸钾制取并收集较纯净的氧气,则应选择装置组合________(填字母),其反应的化学方程式是________________;
(3)用D装置收集氧气,验满的方法是________________________;
(4)若用F装置充满水来收集氧气,气体应从________(填a或b)端通入;
(5)某校兴趣小组取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
①完全反应后,生成氧气的质量为________g;
②原混合物中氯酸钾的质量分数是多少?(精确到0.1%)________