题目内容
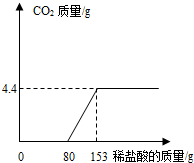 某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水150g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示(提示:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑).该废水中Na2CO3的质量分数和所用稀盐酸中溶质的质量分数分别是多少?
某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水150g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示(提示:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑).该废水中Na2CO3的质量分数和所用稀盐酸中溶质的质量分数分别是多少?分析:根据图象可知生成二氧化碳的质量;根据二氧化碳的质量计算出与碳酸钠反应的氯化氢的质量,用氯化氢的质量除以与碳酸钠反应的盐酸的质量;根据二氧化碳的质量算出碳酸钠的质量,再用碳酸钠的质量除以废水的质量乘以百分之百.
解答:解:设废水中含Na2CO3的质量为x,与Na2CO3反应的稀盐酸中溶质的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y 4.4g
=
=
x=10.6g y=7.3g
故溶液中碳酸钠的质量分数为=
×100%=7.1%
由图象信息可知与碳酸钠反应的盐酸的质量是153g-80g,所以盐酸的质量分数为=
×100%=10%
答:该废水中Na2CO3的质量分数和所用稀盐酸中溶质的质量分数分别是7.1%和10%;
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y 4.4g
| 106 |
| x |
| 73 |
| y |
| 44 |
| 4.4g |
x=10.6g y=7.3g
故溶液中碳酸钠的质量分数为=
| 10.6g |
| 150g |
由图象信息可知与碳酸钠反应的盐酸的质量是153g-80g,所以盐酸的质量分数为=
| 7.3g |
| 153g-80g |
答:该废水中Na2CO3的质量分数和所用稀盐酸中溶质的质量分数分别是7.1%和10%;
点评:本题容易出错的地方是计算盐酸质量分数时,根据二氧化碳算出的氯化氢不能除以总盐酸的质量,由图示可知与碳酸钠反应消耗的盐酸质量为:153g-80g=73g.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
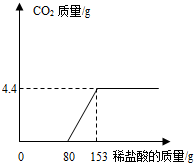 (2012?百色)某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如下图所示:
(2012?百色)某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如下图所示: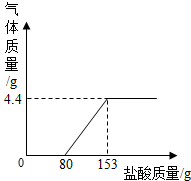 (2013?河北区一模)某造纸厂排放的废水中含有Na2CO3和NaOH,为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.
(2013?河北区一模)某造纸厂排放的废水中含有Na2CO3和NaOH,为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.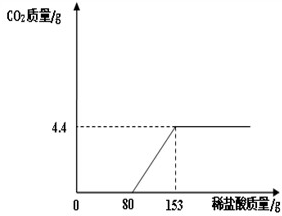 某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示:
某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示: 某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴滴加稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.
某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴滴加稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.