题目内容
【题目】物质X在4.8g氧气中恰好完全燃烧,反应方程式为X+3O2 ![]() RO2+2SO2 , 测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )
RO2+2SO2 , 测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )
A.参加反应的X的质量为4.3g
B.X的相对分子质量为76
C.X中含有R元素、S元素和O元素
D.产物为气态时都是空气污染物
【答案】B
【解析】A、根据质量守恒定律知道参加反应的X的质量为2.2克+6.4克-4.8克=3.8克,A不符合题意;
B、设X的相对分子质量是a,
X+ | 3O2 |
a | 96 |
3.8g | 4.8g |
列比例式得:a:96=3.8g:4.8g
解得a=76,B符合题意;
C、根据元素守恒,X中含有R和S,但不一定含O;C不符合题意;
D、如果R是C时,不会让污染坏境,D不符合题意.
故答案为:B。
本题主要考察对化学式的意义和纯净物中元素质量关系的掌握。其中元素质量之比等于该原子相对原子质量乘以原子个数与所在分子相对分子质量之比;化学式中右下角数字表示原子个数;元素质量之比等于相对原子质量乘以原子个数之比。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】某班同学分别用向上排气法(瓶中加2mL水,标为甲)和排水法(瓶里留有2mL水,标为乙)各收集一瓶氧气,然后进行铁丝燃烧的实验,发现:铁丝在甲瓶中不能燃烧,在乙瓶中火星四射。
【提出问题】铁丝燃烧与___________________有关。
【查阅资料】氮气性质稳定,在加热条件下不与铁、碳、氧气等物质反应。
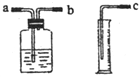
【讨论方案】如果选用如图16所示的仪器收集氧气,仪器接口的连接顺序是_________填“a”“b”或“c”)。
【进行实验】取5根相同的铁丝(直径0.6mm),卷成相同的螺旋状后,分别在体积分数不同的集气瓶中进行实验,如下图所示。实验记录如下:
实验次数 | 氧气的体积分数% | 实验现象 |
第一次 | 90% | 燃烧剧烈,火星四射,燃烧时间长,实验成功 |
第二次 | 80% | 燃烧现象与90%的相比没有明显差异,实验成功 |
第三次 | 70% | 燃烧比80%的弱,燃烧时间比80%的短,实验成功 |
第四次 | 60% | 燃烧比70%的弱,燃烧时间更短,实验成功 |
第五次 | 50% | 铁丝没有燃烧 |
(1)铁丝燃烧的化学方程式为_____________________________________。
(2)通过这组探究实验,可得出的结论是______________________________________。
(3)要研究铁丝的粗细对铁在氧气中燃烧的影响,下列实验能达到目的的是_______________
A.在同一瓶氧气中,先后进行不同粗、细铁丝的燃烧实验
B.在两瓶不同浓度的氧气中,分别同时进行粗、细铁丝的燃烧实验
C.在两瓶相同浓度的氧气中,分别进行粗、细铁丝的燃烧实验
【反思与评价】
(1)对氧气纯度要求较高的实验应采用______________方法收集氧气。
(2)在以上的实验中,某同学将集气瓶中装入一半的水,塞紧瓶塞,再通过排水法收集氧气,当把水排净时,收集到的氧气的体积分数约为(______)
A. 50% B.60% C.70% D.80%