题目内容
某温度下,向一未饱和的Na2CO3溶液中加入20g无水Na2CO3或加入50gNa2CO3?7H2O晶体,都恰好使溶液达到饱和,则Na2CO3在此温度时的溶解度为( )
| A、25g | B、75g | C、50g | D、10g |
分析:首先找出饱和体系,设原不饱和溶液的质量为M,则组成为“M+20g无水碳酸钠”属于饱和体系;
同理,组成为“M+50gNa2CO3?7H2O”也属于饱和体系;
那么二者的质量之差所得部分也一定是饱和体系,即50gNa2CO3?7H2O与20g无水Na2CO3之差的组成.
分析该组成中的溶质和溶剂,利用溶解度概念即可求出溶解度.
同理,组成为“M+50gNa2CO3?7H2O”也属于饱和体系;
那么二者的质量之差所得部分也一定是饱和体系,即50gNa2CO3?7H2O与20g无水Na2CO3之差的组成.
分析该组成中的溶质和溶剂,利用溶解度概念即可求出溶解度.
解答:解:50gNa2CO3?7H2O晶体中含无水碳酸钠的质量为:50g×
×100%=22.8g;则含水的质量为50g-22.8g=27.2g
根据题意可知将(22.8g-20g)=2.8g无水碳酸钠溶于27.2g水中,恰好可以得到该温度下的饱和溶液.
设此温度下碳酸钠的溶解度为s
则有:
=
解之得:s=10g
故选D
| 106 |
| 232 |
根据题意可知将(22.8g-20g)=2.8g无水碳酸钠溶于27.2g水中,恰好可以得到该温度下的饱和溶液.
设此温度下碳酸钠的溶解度为s
则有:
| 100g |
| s |
| 27.2g |
| 2.8g |
解之得:s=10g
故选D
点评:对于有关溶解度的计算题,关键必须找出该温度的饱和溶液,求出饱和溶液中溶质、溶剂或溶液的质量,然后利用公式
=
,求出溶解度.
| 100g |
| 溶解度 |
| 溶剂的质量 |
| 溶质的质量 |

练习册系列答案
相关题目
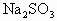 溶液中加入20g无水
溶液中加入20g无水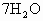 晶体,都恰好使溶液达到饱和,则
晶体,都恰好使溶液达到饱和,则