题目内容
【题目】粗盐的主要成分是NaCl,下面是除去粗盐中MgCl2、Na2SO4、CaCl2等杂质的流程图(提示:微溶物不形成沉淀)
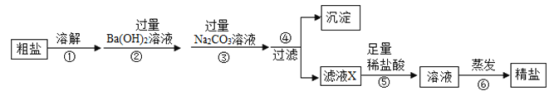
(1)写出操作②中发生的化学反应方程式(写出一个即可)
_______________。
(2)写出加入过量Na2CO3溶液的目的。
_______________。
(3)滤波X中含有几种溶质?
_______________。
【答案】![]() 或
或![]() 除氯化钙、氯化钡和过量的氢氧化钡(除去Ca2+、Ba2+) 三种溶质(氯化钠、碳酸钠和氢氧化钠;或NaCl、Na2CO3、NaOH)
除氯化钙、氯化钡和过量的氢氧化钡(除去Ca2+、Ba2+) 三种溶质(氯化钠、碳酸钠和氢氧化钠;或NaCl、Na2CO3、NaOH)
【解析】
①溶解过滤先除去不溶性杂质;
②加入过量的氢氧化钡溶液,可以同时除去杂质氯化镁、硫酸钠,生成的氢氧化钠、氯化钡和过量的氢氧化钡是新的杂质;
③加入的过量碳酸钠可以除去杂质氯化钙、氯化钡和氢氧化钡,过滤后,滤液X中含有氯化钠、氢氧化钠和碳酸钠;
④过滤将生成的沉淀与溶液分离;
⑤足量稀盐酸除去溶液中的Na2CO3、NaOH,使溶液中只有氯化钠,和过量的盐酸;
⑥蒸发的过程中,先将盐酸的溶质氯化氢挥发除去,再继续蒸发使水蒸发,得到精盐。
(1)根据分析可知,步骤②中涉及到的反应有为:氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡。或氢氧化钡和硫酸镁反应生成硫酸钡沉淀和氢氧化钠。故答案为:![]() 或
或![]() ;
;
(2)通过分析可知,加入过量的Na2CO3的目的是除去氯化钙、氯化钡、过量的氢氧化钡。故答案为:除氯化钙和氯化钡、过量的氢氧化钡(或回答:除去Ca2+、Ba2+);
(3)通过分析可知,滤液X中的溶质有三种,分别是氯化钠、碳酸钠、氢氧化钠。故答案为:三种溶质(或回答:氯化钠、碳酸钠和氢氧化钠;或回答:NaCl、Na2CO3、NaOH)。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】许多物质在常温时能与空气中的氧气、水蒸气、二氧化碳等物质发生反应而变质,下面我们对有关物质的变质情况进行探究。
探究一 生石灰常用作食品干燥剂,但是撕开包装袋后的生石灰常常粘接成块,其原因是__(写出任意一个反应的化学方程式)。
探究二 实验室有一瓶敞口放置的氢氧化钠溶液,对该溶液是否完全变质,小文同学进行如下探究:
实验步骤 | 实验现象 | 结 论 |
(1)取少量溶液于试管中,滴加足量氢氧化钡溶液。 | 有白色沉淀生成 | 氢氧化钠溶 液部分变质 |
(2)过滤,向滤液中加入____(填写一种盐溶液的化学式)。 | ______ |
(反思评价)经分析该实验存在明显的不足,我的改进建议是____。除去该氢氧化钠溶液中的杂质,发生反应的化学方程式为___。
(归纳整理)验证物质是否变质,其实质是要验证变质后的物质是否存在;验证物质是否完全变质,还要验证变质前的物质是否存在。
探究三 实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,智慧小组对一瓶久置的“碱石灰”变质情况作了如下探究。
(提出猜想)变质的碱石灰样品的主要成分可能含有氧化钙、氢氧化钠、氢氧化钙、碳酸钙和____(填化学式或名称均可,下同)。
(实验探究)小组讨论后设计如下实验进行探究:
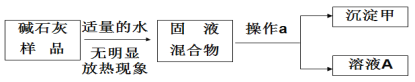
(思考分析)碱石灰样品中一定不含___,溶液A中溶质的组成可能有__种不同的组合。
(延伸探究)为了进一步验证碱石灰样品的成分,同学们继续设计实验:取少量溶液A于试管中,加入过量的氯化钡溶液和无色酚酞溶液,静置。小组同学对可能出现的现象、溶液A中溶质、碱石灰样品的成分进行如下
可能出现的实验现象 | A中溶质 | 碱石灰样品成分 |
有白色沉淀生成,上层清液为红色 | ___ | 一定含有碳酸钠和氢氧化钙。 |
有白色沉淀生成,上层清液为无色 | ___ | ___ |
(实践运用)由上述实验说明,实验室中“碱石灰”应密封保存。