题目内容
【题目】根据内容填空:
(1)用如图1所示装置进行实验,探究物质溶解是吸热还是放热,仪器a的名称是 . 若出现导管中红墨水液面左管降低右管升高,则试管中加入的物质可以是(填序号). 
A.NH4NO3固体;B.浓硫酸;C.NaOH固体;D.CaCO3固体.
(2)实验室用氯酸钾和二氧化锰制氧气,反应的化学方程式是 , 反应中二氧化锰的作用是 . 要从充分反应后的剩余固体中分离出氯化钾晶体,需要进行的实验操作有 .
(3)某化学学习小组的同学在网上查资料时得知,金属钠着火不能用CO2灭火.他们想知道,Na与CO2反应究寓会生成什么物质呢? 【提出猜想】
Ⅰ.4Na+CO2 ![]() 2Na2O+C
2Na2O+C
Ⅱ.4Na+3CO2 ![]() 2Na2CO3+C
2Na2CO3+C
III.2Na+2CO2 ![]() Na2O+2CO
Na2O+2CO
溶液检验:PdCl2+CO+H2O═Pd(黑色)↓+2HCl+CO2
【实验操究】该小组成员设计了如图2所示实验: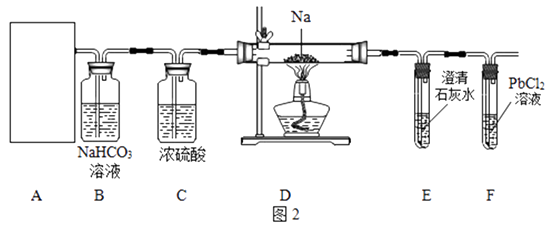
【分析讨论】
①装置A用盐酸与石灰石反应制备CO2 , 反应的化学方程式为 . 为使制备CO2的反应能随开随用,随关随停,所选装置应是图3中的 . 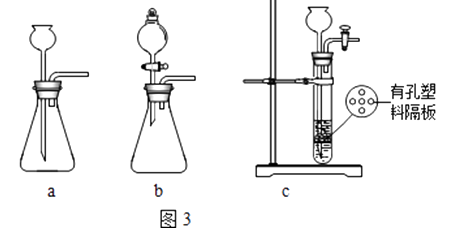
②装置B的作用是除去二氧化碳气体中混有的HCl气体,反应的化学方程式是;装置C的作用是 .
③经检查整套装置气密性良好,装好药品使A中产生CO2 , 必须待装置E中出现现象时再点燃酒精灯,其目的是 .
【实验结论】
实验观察到的现象是:装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,则猜想是正确的.
【答案】
(1)广口瓶;BC
(2)2KClO3 ![]() 2KCl+3O2↑;作催化剂;溶解、过滤、蒸发
2KCl+3O2↑;作催化剂;溶解、过滤、蒸发
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑;c;HCl+NaHCO3═NaCl+H2O+CO2↑;除去二氧化碳气体中的水蒸气;澄清石灰水变浑浊;排出反应装置中的空气,防止钠与氧气反应;Ⅲ
【解析】解:(1)仪器a的名称是广口瓶;导管中红墨水液面左管降低右管升高,则试管中加入的物质溶于水时放热,NH4NO3固体溶于水时吸热;浓硫酸溶于水时放热;NaOH固体溶于水时放热;CaCO3固体不溶于水;(2)实验室用氯酸钾和二氧化锰制氧气,反应的化学方程式是2KClO3 ![]() 2KCl+3O2↑;反应中二氧化锰的作用是做催化剂;要从充分反应后的剩余固体中分离出氯化钾晶体,需要进行的实验操作有溶解、过滤、蒸发;(3)【分析讨论】①盐酸与石灰石反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;为使制备CO2的反应能随开随用,随关随停,所选装置应是图3中的c.②碳酸氢钠和氯化氢反应生成氯化钠、水和二氧化碳,反应的化学方程式是HCl+NaHCO3═NaCl+H2O+CO2↑;浓硫酸具有吸水性,能除去二氧化碳气体中的水蒸气;③为防止钠与氧气反应,因此应先排出反应装置中的空气,当装置E中澄清石灰水变浑浊时,说明空气已排除完毕; 【实验结论】 根据题中信息可知,若装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,则猜想Ⅲ正确;
2KCl+3O2↑;反应中二氧化锰的作用是做催化剂;要从充分反应后的剩余固体中分离出氯化钾晶体,需要进行的实验操作有溶解、过滤、蒸发;(3)【分析讨论】①盐酸与石灰石反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;为使制备CO2的反应能随开随用,随关随停,所选装置应是图3中的c.②碳酸氢钠和氯化氢反应生成氯化钠、水和二氧化碳,反应的化学方程式是HCl+NaHCO3═NaCl+H2O+CO2↑;浓硫酸具有吸水性,能除去二氧化碳气体中的水蒸气;③为防止钠与氧气反应,因此应先排出反应装置中的空气,当装置E中澄清石灰水变浑浊时,说明空气已排除完毕; 【实验结论】 根据题中信息可知,若装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,则猜想Ⅲ正确;
所以答案是:(1)广口瓶; BC;(2)2KClO3 ![]() 2KCl+3O2↑;作催化剂;溶解、过滤、蒸发;(3)【分析讨论】①CaCO3+2HCl═CaCl2+H2O+CO2↑;c;②HCl+NaHCO3═NaCl+H2O+CO2↑;除去二氧化碳气体中的水蒸气;③澄清石灰水变浑浊;排出反应装置中的空气,防止钠与氧气反应;【实验结论】根据实验观察到的现象是:装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,说明猜想Ⅲ是正确的;所以答案是:Ⅲ.
2KCl+3O2↑;作催化剂;溶解、过滤、蒸发;(3)【分析讨论】①CaCO3+2HCl═CaCl2+H2O+CO2↑;c;②HCl+NaHCO3═NaCl+H2O+CO2↑;除去二氧化碳气体中的水蒸气;③澄清石灰水变浑浊;排出反应装置中的空气,防止钠与氧气反应;【实验结论】根据实验观察到的现象是:装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,说明猜想Ⅲ是正确的;所以答案是:Ⅲ.
【考点精析】认真审题,首先需要了解混合物的分离方法(混合物的分离:1、过滤法:分离可溶物 + 难溶物2、结晶法:分离几种可溶性物质),还要掌握催化剂的特点与催化作用(催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用)的相关知识才是答题的关键.
