题目内容
人类生活生产离不开金属,不仅因为其物理性能优良,还与化学性质密切相关.
(1)态被称为“21世纪金属”,呈灰色,能在氮气中燃烧,熔点高.钛和钛合金是新型的结构材料,主要用于航天和航海工业.上述描述中属于钛化学性质的是 .
(2)某小组用图所示装置对铁生锈的条件进行探究.4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是 .
(3)工业生产常用10%的稀盐酸来除铁锈,写出除锈的化学反应方程式 ;实验室用浓盐酸配制10%稀盐酸时,用到的主要仪器有 。
(4)在金属活动顺序表中,金属位置越靠前,越容易失去电子.Ca、Mg、K三种金属失去电子能力由强到弱的顺序是 ,如图是三种原子的结构示意图,据此推测金属失去电子能力的强弱除与最外层电子数有关外,还可能与 有关.


(1)能在氮气中燃烧 (2)氧气的浓度 (3)Fe2O3+6HCl=2FeCl3+3H2O 量筒、烧杯、玻璃棒、胶头滴管 (4)K、Ca、Mg;电子层数
【解析】
试题分析:(1)物质在化学变化中表现出来的性质叫做物质的化学性质,例如可燃性、还原性等,故答案为:能在氮气中燃烧;
(2)铁生绣的条件是铁与氧气、水共同作用的结果,对比A、B两图,就是空气与氧气的差别,故答案为:氧气的浓度;
(3)铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水;配制溶液所需要的仪器主要有量筒、烧杯、玻璃棒、胶头滴管,故答案为:Fe2O3+6HCl=2FeCl3+3H2O 量筒、烧杯、玻璃棒、胶头滴管
(4)根据所学的金属活动性顺序和题目的已知条件“在金属活动顺序表中,金属位置越靠前,越容易失去电子”,可知Ca、Mg、K三种金属失去电子能力由强到弱的顺序是K、Ca、Mg;根据题目所给的原子结构示意图,发现Mg比K、Ca少一个电子层,故答案为:K、Ca、Mg;电子层数.
考点:金属的物理性质及用途;一定溶质质量分数的溶液的配制;金属活动性顺序及其应用;金属锈蚀的条件及其防护;酸的化学性质;核外电子在化学反应中的作用.
点评:此题综合考查学生对金属有关知识的掌握程度,提高分析和解决实际实际问题的能力,是中考考试的热点.

 (2013?莱芜)人类生活生产离不开金属,不仅因为其物理性能优良,还与化学性质密切相关.
(2013?莱芜)人类生活生产离不开金属,不仅因为其物理性能优良,还与化学性质密切相关.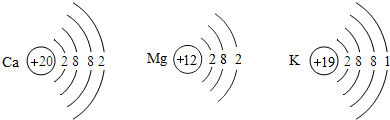

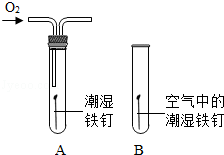
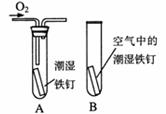 (2)某小组用图所示装置对铁生锈的条件进行探究。4min后发现
(2)某小组用图所示装置对铁生锈的条件进行探究。4min后发现 (4)在金属活动顺序表中,金属位置越靠前,越容易失去电子。Ca、 Mg、 K三种金属失电子能力由强到弱的顺序是 ,如图是三种原子的结构示意图,据此推测金属失电子能力的强弱除与最外层电子数有关外,还可能与 有关。
(4)在金属活动顺序表中,金属位置越靠前,越容易失去电子。Ca、 Mg、 K三种金属失电子能力由强到弱的顺序是 ,如图是三种原子的结构示意图,据此推测金属失电子能力的强弱除与最外层电子数有关外,还可能与 有关。
