题目内容
(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
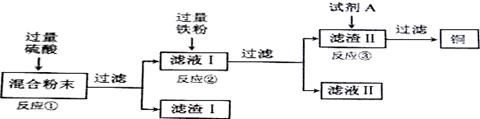
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜 想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
|
实验方案 |
实现现象 |
结论 |
|
①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. |
合金中一定含有 . |
|
②取步骤①所得滤渣,加过量的_________,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. |
合金中一定含有 . |
【探究结论】猜想3成立.
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式 .
(1)反应①:H2SO4 + CuO ="==" CuSO4 + H2O
反应②:Fe + CuSO4 ="==" FeSO4 + Cu
(2) 10g;30g。
(3)烧杯;用玻璃棒不断搅拌。
(4)H2SO4 (CuSO4 等合理即给分)
(5) 猜测二:铜
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
①30%NaOH溶液 |
|
铝 |
|
②10%盐酸 |
|
铁、铜 |
【反 思】 2Al+6HCl=2AlCl3+3H2↑
【解析】
试题分析:由题意可得:
(1)化学方程式:反应①:H2SO4 + CuO ="==" CuSO4 + H2O; 反应②:Fe + CuSO4 ="==" FeSO4 + Cu。
(2)要配制40g 24.5%的硫酸,需(40×24.5%)/98%=10g98%的硫酸和40-10=30g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入烧杯中(填仪器名称),然后用玻璃棒不断搅拌,使反应充分进行.
(4)试剂A可选用H2SO4 (CuSO4 等合理即给分)溶液(填一种物质的化学式)
(5)猜想2:该合金粉末中除铝外,还含有铜(填名称).
【实验探究】
|
实验方案 |
实现现象 |
结论 |
|
①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. |
合金中一定含有铝. |
|
②取步骤①所得滤渣,加过量的10%盐酸,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. |
合金中一定含有铁、铜. |
【反思】铝与稀盐酸反应的化学方程式为2Al+6HCl=2AlCl3+3H2↑。
考点:物质推断;化学方程式的书写;金属活动性。
点评:本题难度较大,解答本题的关键是充分读懂题中信息,其中设计实验方案是个难点,结合题中信息“铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应”来设计实验方案,才是正确的思路。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜 想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 . |
| ②取步骤①所得滤渣,加过量的_________,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 . |
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式 .