题目内容
10g铜与锌的混合物与100g9.8%的稀硫酸恰好完全反应,求:
(1)原混合物中铜的质量?
(2)反应后溶液中溶质的质量分数?(结果保留到0.1%).
(1)原混合物中铜的质量?
(2)反应后溶液中溶质的质量分数?(结果保留到0.1%).
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)锌可以和稀硫酸反应,而铜不能反应,可以根据稀硫酸中硫酸的质量,结合锌与硫酸反应的化学方程式可以计算出锌的质量,进而计算出铜的质量.
(2)可以根据稀硫酸中硫酸的质量,结合锌与硫酸反应的化学方程式可以计算出生成的硫酸锌的质量和氢气的质量,然后结合溶液中溶质的质量分数的计算公式进行解答即可.
(2)可以根据稀硫酸中硫酸的质量,结合锌与硫酸反应的化学方程式可以计算出生成的硫酸锌的质量和氢气的质量,然后结合溶液中溶质的质量分数的计算公式进行解答即可.
解答:解:100g 9.8%的稀硫酸中硫酸的质量为100g×9.8%=9.8g
设锌的质量为x,生成硫酸锌的质量为y,氢气的质量为z
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x 9.8g y z
=
=
=
x=6.5g,y=16.1g,z=0.2g
(1)原混合物中铜的质量:10g-6.5g=3.5g;
(2)反应后溶液中溶质的质量分数:
×100%=15.1%.
答:原混合物中铜的质量为3.5g;反应后溶液中溶质的质量分数为15.1%.
设锌的质量为x,生成硫酸锌的质量为y,氢气的质量为z
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x 9.8g y z
| 65 |
| x |
| 98 |
| 9.8g |
| 161 |
| y |
| 2 |
| z |
x=6.5g,y=16.1g,z=0.2g
(1)原混合物中铜的质量:10g-6.5g=3.5g;
(2)反应后溶液中溶质的质量分数:
| 16.1g |
| 6.5g+100g-0.2g |
答:原混合物中铜的质量为3.5g;反应后溶液中溶质的质量分数为15.1%.
点评:根据化学方程式可以表示反应中各物质的质量关系,由反应中一种物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
工业上制取水煤气的化学方程式为C+H2O
CO+H2.下列对该反应的认识错误的是( )
| 高温 |
| A、该反应是置换反应 |
| B、反应的生成物具有助燃性 |
| C、反应前后原子种类和数目不变 |
| D、反应中碳元素的化合价升高,氢元素的化合价降低 |
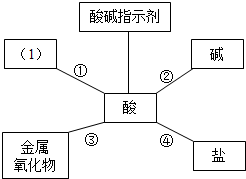 构建知识网络能帮助我们理解知识间的内在联系,请分析以下知识网络图,回答有关问题.
构建知识网络能帮助我们理解知识间的内在联系,请分析以下知识网络图,回答有关问题.