题目内容
【题目】以下改进实验能够更好地达成实验目的。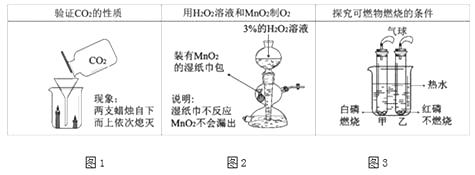
①图1实验说明了二氧化碳具有的性质是;
②按图2所示进行实验可以制取氧气,用启普发生器制取氧气的优点是(写一点),写出该反应的化学方程式;
③图3实验证明了可燃物燃烧的条件之一为 , 写出白磷燃烧的化学方程式;
④待图3实验结束后,将甲试管从烧杯中取出并按下图进行实验。若白磷足量,理论上进入试管中的水的体积约占试管容积的。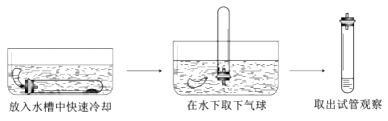
【答案】密度比空气大、不能燃烧、不能支持燃烧;可随时控制反应的发生和停止;2H2O2![]() 2H2O+O2↑;可燃物燃烧温度需达到着火点;4P+5O2
2H2O+O2↑;可燃物燃烧温度需达到着火点;4P+5O2![]()
![]() 2P2O5;
2P2O5;![]()
【解析】①实验中可观察到蜡烛由低到高依次熄灭,所以可推知二氧化碳的性质有: 密度比空气大、不能燃烧、不能支持燃烧;
②关闭弹簧夹,容器内气体增多,压强变大,在压力的作用下,容器内液面下降,当液面下降到细颈下边时,固体反应物与液体分离,反应停止;反之,打开弹簧夹,反应开始。所以用启普发生器制取氧气的优点是可随时控制反应的发生和停止;过氧化氢溶液和二氧化锰在常温下反应生成氧气,反应方程式为; 2H2![]() O
O![]() 2H2O+O2↑;
2H2O+O2↑;
③燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;实验3中白磷燃烧,红磷不燃烧,说明可燃物燃烧温度需达到着火点;磷和氧气点燃条件下生成五氧化二磷,反应方程式为 4P+5O2![]()
![]() 2P2O5;
2P2O5;
④测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶、试管内气体减少,压强变小,水倒流入试管内,倒流的水的体积就等于试管内氧气的体积。理论上进入试管中的水的体积约占试管容积的![]() .
.
故答案为:密度比空气大、不能燃烧、不能支持燃烧;可随时控制反应的发生和停止;2H2O2![]() 2H2O+O2↑;可燃物燃烧温度需达到着火点;4P+5O2
2H2O+O2↑;可燃物燃烧温度需达到着火点;4P+5O2![]() 2P2O5;
2P2O5;![]() .
.
①蜡烛会熄灭,说明二氧化碳不能燃烧也不能支持燃烧,底下的蜡烛先熄灭,上面的蜡烛后熄灭,说明二氧化碳的密度比空气大;
②启普发生器可随时控制反应的发生和停止;过氧化氢在二氧化锰的催化下生成水和氧气;
③根据白磷燃烧的现象及燃烧的条件分析解答;磷和氧气点燃条件下生成五氧化二磷;
④氧气约占空气体积的![]() .
.

【题目】膨松剂是一种食品添加剂,某研究小组对膨松剂进行了如下探究 【趣味实验】
实验1:和面.向20g面粉中加入10mL水,制得的面团编为1号;向20g面粉中加入10mL水,再加入2g膨松剂M,制得的面团编为2号.
实验2:发面.将和好的2个面团放入微波炉中加热,几分钟后,取出面团,发现1号面团无明显胀大,2号面团明显胀大且手感比较松软.
【提出问题】膨松剂M的成分是什么?
【提出假设】
假设1:M是NH4HCO3;
假设2:M是NaHCO3;
假设3:M是NH4HCO3和NaHCO3
(1)【实验探究1】
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 取少量M于试管中,加热一段时间 | 无刺激性气味 | 假设成立 |
(2)【提出新问题】实验①试管中剩余固体是什么? 【实验探究2】
实验②:将实验①所得固体继续加热,无明显现象.冷却,向试管中加水,固体全部溶解,将所得溶液分为2份;向其中1份溶液中滴加稀盐酸,有气泡生成,将生成的气体通入澄清石灰水,有白色沉淀;向另1份溶液中滴加足量氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液不变红.
【得出结论】
实验①试管中剩余固体是(填化学式)
(3)【反思提高】 ①NH4HCO3受热分解的化学方程式是 .
②受热稳定性:Na2CO3(填“>”“=”或“<”)NaHCO3 .
(4)【拓展应用】 某品牌复配膨松剂N的配料为:磷酸二氢钙、碳酸氢钠和玉米淀粉,N遇水会发生如下反应:Ca(H2PO4)2+2NaHCO3═CaHPO4↓+Na2HPO4+2CO2↑+2H2O;利用N和面和发面(加热)时,面团都会胀大.下列叙述正确的是(填序号)
a.常温下的溶解度:Na2HPO4>CaHPO4
b.碳酸氢钠在水溶液中遇到酸性物质能产生气体
c.根据上述反应,产生0.22gCO2至少需要NaHCO3的质量为0.42g.

