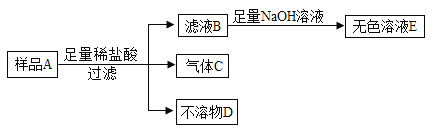
题目内容
【题目】取某碳酸钠样品(含有一定量的氯化钠)15g,加入80g水,固体完全溶解,再向其中加入76g氯化钙溶液,两者恰好完全反应,过滤后得到161g滤液。
请计算:(1)产生沉淀的质量是________g;
(2)反应后所得溶液中溶质的质量分数_______。
【答案】10g 10%
【解析】
(1)根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钙发生反应,碳酸钠与氯化钙生成碳酸钙沉淀和氯化钠,根据质量守恒计算碳酸钙沉淀的质量;
(2)恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成。
(1)产生沉淀的质量为15g+80g+76g-161g=10g;
(2)设Na2CO3的质量为x,生成NaCl的质量为y,
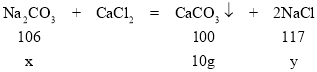
![]()
x=10.6g,y=11.7g
反应后所得溶液中溶质的质量=15g-10.6g+11.7g=16.1g;
反应后所得溶液中溶质质量分数为![]() ×100%=10%
×100%=10%
答:(1)产生沉淀的质量为10g;(2)反应后所得溶液中溶质质量分数为10%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案.

(1)其中能达到实验目的是 .
(2)在C组实验中发生的化学方程式为 .
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色.
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性.使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物.
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证.请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是 .
【题目】填写下列物质的名称或化学式,并指出类别(非金属单质、金属单质、化合物或氧化物)
物质名称 | _____ | 碳酸钙 | _____ | _____ |
化学式 | _____ | _____ | SiO2 | Ca(OH)2 |
类别 | 非金属单质 | _____ | _____ | _____ |