题目内容
【题目】现有下列四组物质:①乙炔(C2H2)和苯(C6H6);②乙烷(C2H6)和乙醇(C2H6O);③丁烷(C4H10)和乙醚(C4H10O);④甲苯(C7H8)和甘油(C3H8O3)。当总质量一定时,各组中的两种物质无论按何种质量比混合,完全燃烧生成水的质量均相同。符合该条件的共有
A.1组 B.2组 C.3组 D.4组
【答案】B
【解析】
试题分析∶ 根据定组成定律和化学方程式可知(1)(4)组符合,(2)(3)组不符合。
考点∶ 考查根据定组成定律和化学方程式的应用。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】针对下列事实的解释正确的是( )
事实 | 解释 | |
A | 二氧化氮气体为红棕色 | 二氧化氮分子是红棕色 |
B | H2O和H2O2化学性质不同 | 两种物质的分子中原子的种类不同 |
C | 夏天钢轨之间的绩隙变小 | 分子之间有间隔 |
D | 木炭燃烧生成二氧化碳或一氧化碳 | 反应物的质最不同生成物可能不同 |
A. A B. B C. C D. D
【题目】空气中氧气含量测定的再认识.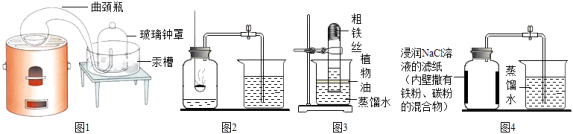
(1)【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1).该实验中选择使用汞的优点有 .
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气集合耗尽
(2)【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式 . 兴趣小组用该方法测出的氧气含量常常远低于21%.
(3)【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2)装置内氧气有剩余;…
(4)【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因 .
(5)【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%.
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因: .
(6)【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氧化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量(计算结果保留一位小数).
(7)【结论与反思】通过上述实验探究,选择(填物质名称)进行实验,可较为快速地完成实验并减小实验误差.
(8)【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由. .