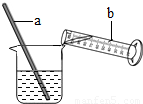
题目内容
26.(2007?福州)肥田粉的主要成分是硫酸铵.现有一包标有含氮量为20.0%的肥田粉样品,小庆和小鸿为了计算该肥田粉中硫酸铵的质量分数,他们称取7.5g样品,分别采用下列方法:
(1)请你根据小鸿的实验结果,计算样品中硫酸铵的质量分数.
(2)你的计算结果和小庆计算结果______(填“相同”或“不相同”),原因是______
(3)根据小鸿实验的反应原理分析:施用肥田粉时应注意______.
【答案】分析:(1)由生成氨气的质量根据硫酸铵与氢氧化钙反应的化学方程式可以计算出样品中硫酸铵的质量分数.
(2)结果与小庆的比较,若偏小,可能是由实验过程中氨气逸出、称量有误或原包装上的含氮量20.0%有误造成.
(3)硫酸铵与熟石灰能反应生成氨气,若混合施用会造成肥分的损失.
解答:解:(1)设样品中硫酸铵的质量分数为x.
(NH4)2SO4+Ca(OH)2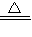 CaSO4+2NH3↑+2H2O
CaSO4+2NH3↑+2H2O
132 34
7.5g?x 1.7g
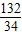 =
=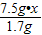 ,x=88%
,x=88%
(2)不相同;实验过程中氨气逸出、称量有误或原包装上的含氮量为20.0%有误.
(3)施用肥田粉时应注意不与熟石灰混用.
故答案为(1)88%.
(2)不相同;实验过程中氨气逸出、称量有误或原包装上的含氮量为20.0%有误.
(3)施用肥田粉时应注意不与熟石灰混用.
点评:本题主要考查含杂质物质的化学方程式计算,难度稍大.
(2)结果与小庆的比较,若偏小,可能是由实验过程中氨气逸出、称量有误或原包装上的含氮量20.0%有误造成.
(3)硫酸铵与熟石灰能反应生成氨气,若混合施用会造成肥分的损失.
解答:解:(1)设样品中硫酸铵的质量分数为x.
(NH4)2SO4+Ca(OH)2
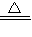 CaSO4+2NH3↑+2H2O
CaSO4+2NH3↑+2H2O132 34
7.5g?x 1.7g
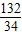 =
=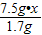 ,x=88%
,x=88%(2)不相同;实验过程中氨气逸出、称量有误或原包装上的含氮量为20.0%有误.
(3)施用肥田粉时应注意不与熟石灰混用.
故答案为(1)88%.
(2)不相同;实验过程中氨气逸出、称量有误或原包装上的含氮量为20.0%有误.
(3)施用肥田粉时应注意不与熟石灰混用.
点评:本题主要考查含杂质物质的化学方程式计算,难度稍大.

练习册系列答案
相关题目
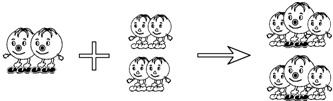 (2007?福州)某两种物质在一定条件下发生化学反应的微观示意如图(其中
(2007?福州)某两种物质在一定条件下发生化学反应的微观示意如图(其中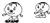 分别表示两种不同的原子).对上述反应,下列说法正确的是( )
分别表示两种不同的原子).对上述反应,下列说法正确的是( )