题目内容
【题目】将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2ml水中(ρ水 = 1g/cm3), 向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应(化学方程式:BaCl2+Na2SO4==BaSO4↓+2NaCl)。右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
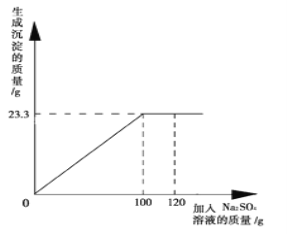
(1)生成沉淀的质量是多少?
(2)所得溶液中溶质的质量分数为多少?
【答案】(1)23.3g (2)10%
【解析】
试题分析:(1)观察图像,一般抓住变化趋势的转折点(拐点),指反应结束的时候,故由图可知,生成BaSO4沉淀的质量为23.3g
(2)根据化学反应:BaCl2+Na2SO4=BaSO4↓+2NaCl中BaSO4与BaCl2、NaCl的质量关系,可分别求出BaCl2、NaCl的质量,进一步可求出所得溶液中溶质NaCl的总质量,最后即可计算所得溶液中溶质的质量分数
解:设BaCl2的质量为x,生成NaCl的质量为y
BaCl2+Na2SO4===BaSO4↓+2NaCl
208 233 117
x 23.3g y
208:233=x:23.3g x=20.8g
233:23.3g=117:y y=11.7g
溶液的总质量为:29.2g+94.2ml*1g/cm3+100g-23.3g=200g
溶质的总质量=11.7g+(29.1g-20.8g)=20g
所得溶液中溶质的质量分数=20g/200g×100%=10%
答:生成沉淀23.3g,所得NaCl溶液的质量分数为10%

练习册系列答案
相关题目