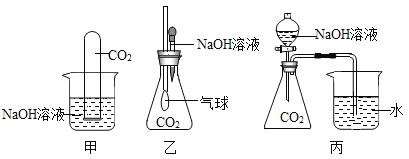
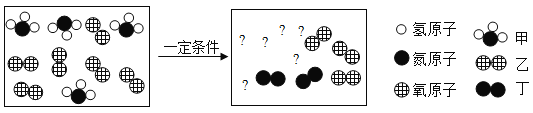
题目内容
【题目】现有碳酸钠和氯化钠的混合物样品12.5g,将其放入干净的烧杯中,加入163.9g水使其完全溶解。向所得溶液中加入溶质质量分数为7.3% 的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
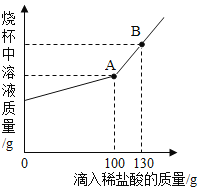
(1)B点时,烧杯中溶液里存在的阳离子为 (填离子符号);
(2)A点时,所得不饱和溶液中溶质质量分数。
【答案】Na+ 、H+;5%
【解析】
碳酸钠和稀盐酸反应生成氯化钠和水和二氧化碳。
(1)碳酸钠和稀盐酸反应生成氯化钠和水和二氧化碳,B点时,稀盐酸过量,故烧杯中溶液里存在的阳离子为钠离子和氢离子,离子符号为Na+ 、H+。
(2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的z
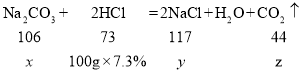
![]()
![]()
![]()
![]()
![]()
![]()
故A点时,所得不饱和溶液中溶质质量分数为![]()
答:A点时,所得不饱和溶液中溶质质量分数为5%。

练习册系列答案
相关题目