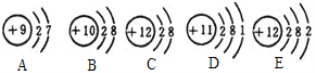
题目内容
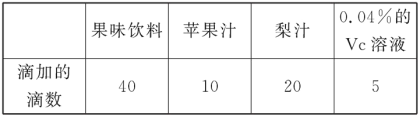
【题目】现有两种稀溶液:标记为A的0.040 0%的氢氧化钠溶液;标记为B的0.365%的盐酸。假设本题所涉及的各种稀溶液的密度均近似为1.00 g·mL-1,且每滴溶液的体积近似为0.05 mL,试解答下列各小题。
(1)恰好完全中和20.0 g A溶液,需加入B溶液多少克?
(2)在盛有20.0 mL A溶液的锥形瓶中滴加2滴酚酞溶液,再向瓶中缓缓倒入10.0 mL B溶液,边倒边振荡,充分混合后溶液呈无色。若取该无色混合液3.00 mL于一支试管内,再向试管内滴加1滴A溶液,试通过计算说明此时试管内溶液呈现的颜色。
【答案】(1)2.00 g
(2)因为中和20.0 g氢氧化钠溶液需0.365%的盐酸2 g。
3.00 mL混合液中剩余氯化氢的质量为:
0.365%×8 g×3.00 mL/30.0 mL=2.92×10-3 g。
设1滴A溶液中的氢氧化钠能中和氯化氢的质量为x。
NaOH + HCl===NaCl+H2O
40 36.5
0.05 g×0.040 0% x
x=1.825×10-5 g≈1.83×10-5 g<2.92×10-3 g;
所以盐酸有剩余,溶液显无色。
【解析】试题分析:已知量:氢氧化钠:20.0g×0.0400%=0.008g; 0.365%的盐酸;10. 0mLB溶液中氯化氢的质量;10. 0mLB溶液;混合液3.00mL;未知量:(l)恰好完全中和20. 0gA溶液,需加入B溶液的质量;(2)试管内溶液的颜色;
解:(1)恰好完全中和20. 0gA溶液,需加入B溶液的质量为x
HCl + NaOH==NaCl+H2O
36.5 40
0.365%x 0.008g
![]() =
=![]()
x=2.00g
(2)20. 0mL氢氧化钠溶液中含有氢氧化钠质量为8g;因为恰好完全中和20. 0gA溶液,需0.365%的盐酸的质量为2.00g,3mL盐酸中氯化氢的质量为:3mL·30mL-1×8g×0.365%=2.92g×10-3g;
设1滴A溶液中的氢氧化钠能中和1氯化氢的质量为y,
HCl + NaOH==NaCl+H2O
36.5 40
y 0.05g×0.04%
![]() =
=![]()
y-1.825g×10-3g<2.92g×10-3g;
所以盐酸有剩余,溶液显无色。

【题目】请你参与某学习小组的探究活动,并回答相关问题:
[发现问题]小丽发现盛水的铁锅在与水面接触的部位最易生锈;小茜发现自己的铜
制眼眶表面出现了绿色的铜锈;小玲发现苹果切开不久,果肉上会产生一层咖啡色物质,好像生了“锈”一般.
[提出问题]这三种物质“生锈”的原因是什么?
[收集证据] (1)回忆已有知识:铁生锈的条件是______________________________.
[查阅有关资料]“铜锈”主要成分是Cu2(OH)2CO3(俗称铜绿);苹果“生锈”是果肉里的物质(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质.碱石灰能吸水.
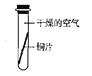
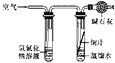
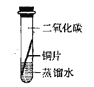
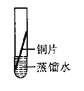
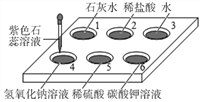
[实验探究]将四小块铜片分别按下图所示放置一个月,观察现象如下:
实验 装置 |
|
|
|
|
实验验象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面附近锈蚀最严重 |
由实验可知,铜生锈是铜与水、__________、_________等物质共同作用的结果.
[得出结论]经过交流讨论,三位同学认为这些物质“生锈”除了可能与水有关外,还可能都与___________________(填物质名称)有关.
[反思与应用] 利用所得结论填空:
(1)写出一种防止铁或铜等金属制品生锈的具体方法_________________________.
(2)请你提出一条延长食品保质期的建议___________________________________.
【题目】某实验小组用氯酸钾和二氧化锰为原料制取氧气,反应过程中测量的有关数据记录如下:
反应时间(min) | 0 | 1 | 2 | 3 | 4 |
试管中固体质量(g) | 14.25 | 12.65 | 11.05 | 9.45 | 9.45 |
(1)反应到______min时,氯酸钾就完全分解。
(2)反应完全时生成氧气的质量为________。
(3)原固体中氯酸钾的质量是_________?