题目内容
【题目】工业盐酸中常混有少量的FeCl3而呈黄色.为测定某工业盐酸中FeCl3的含量进行如下实验:取该工业盐酸100g,滴加溶质质量分数为20%的NaOH溶液,加入NaOH溶液质量与反应生成的沉淀质量关系如图所示.FeCl3与NaOH反应的化学方程式为:FeCl3+3NaOH═Fe(OH)3↓+3NaCl. 请计算: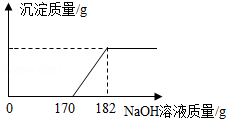
(1)与FeCl3反应消耗的NaOH溶液中溶质的质量是g.
(2)该工业盐酸中FeCl3的质量分数.
【答案】
(1)2.4
(2)解:由图可以看出和氯化铁反应的氢氧化钠溶液的质量为182g﹣170g=12g,其溶质氢氧化钠的质量为12g×20%=2.4g
设与2.4g氢氧化钠反应的氯化铁的质量为x
FeCl3+ | 3NaOH═Fe(OH)3↓+3NaCl |
162.5 | 120 |
x | 2.4g |
![]() =
= ![]()
x=3.25g
该工业盐酸中FeCl3的质量分数为 ![]() ×100%=3.25%
×100%=3.25%
答:该工业盐酸中FeCl3的质量分数为3.25%
【解析】解:由图可以看出和氯化铁反应的氢氧化钠溶液的质量为182g﹣170g=12g,其溶质氢氧化钠的质量为12g×20%=2.4g 设与2.4g氢氧化钠反应的氯化铁的质量为x
FeCl3+ | 3NaOH═Fe(OH)3↓+3NaCl |
162.5 | 120 |
x | 2.4g |
![]() =
= ![]()
x=3.25g
该工业盐酸中FeCl3的质量分数为 ![]() ×100%=3.25%
×100%=3.25%
答:(1)与FeCl3反应消耗的NaOH溶液中溶质的质量是 2.4g.(2)该工业盐酸中FeCl3的质量分数为3.25%.
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

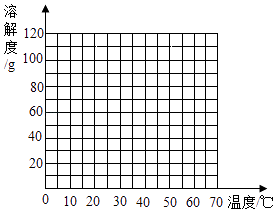
【题目】如表是氯化钠和硝酸钾在不同温度下的溶解度,请回答
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(1)20℃时,100g水中最多可以溶解g氯化钠.
(2)要使接近饱和的硝酸钾溶液变为饱和溶液,可采取的方法是(写1种).
(3)60℃时,KNO3饱和溶液的溶质质量分数为(精确到0.1%).
(4)请在如图坐标系中,用光滑的曲线绘制硝酸钾的溶解度曲线.