题目内容
【题目】有一种未知浓度的稀硫酸600g,向其中加入足量的锌粉,充分反应后过滤,反应中共收集到氢气1.2g,求:
(1)有多少克锌粉参加反应?
(2)所得滤液中溶质的质量分数是多少?(计算结果保留一位小数)
【答案】
(1)
解:设消耗锌粉的质量为x,生成硫酸锌的质量为y.
65 161 2
x y 1.2g
![]() ,
,![]()
解得:x=39g y=96.6g
所以有39克锌粉参加反应。
(2)
由(1)得生成硫酸锌的质量为96.6g
所以滤液中溶质的质量分数=![]() ≈15.1%
≈15.1%
【解析】根据反应方程式,由生成氢气的质量,计算消耗锌的质量和生成硫酸锌的质量;根据溶液中溶质质量分数的计算方法计算所得滤液中溶质的质量分数.注意用总质量守恒法找溶液比较方便.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
相关题目
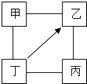
【题目】如图中,“﹣”表示相连的物质间在一定条件下可以反应,“→”表示在一定条件下丁可以转化为乙.如表四组选项中,符合如图要求的是( )
甲 | 乙 | 丙 | 丁 | |
A | H2SO4 | Na2SO4 | NaOH | NaCl |
B | KCl | K2CO3 | KOH | HCl |
C | C | H2O | CO2 | O2 |
D | Fe | CuCl2 | Zn | HCl |
A.A
B.B
C.C
D.D
