题目内容
2011年3月,日本强烈地震后,海啸引发福岛第一核电站的放射性物质外泄,有关l31 I(碘131)的相关报道成为热门话题。请回答下列问题:
(1)l31 I原子中含有53个质子,78个中子。
①l31 I原子的核外电子数为________。
②自然界中普遍存在另一种稳定的碘原子l27I,它和131I同属于碘元素。l27I原子的质子数为__________
(2)专家指出,服用碘片(有效成分为KI)可以治疗131I造成的辐射,但服用碘酒(有效成分为I2)却会引起碘中毒。KI和I2的性质不同的原因是________________。
(3)日本地震后,个别居民抢购食盐。假设某人经医生确认,每日需要补充166mgKI。已知每千克某品牌碘盐中KIO3的加入量为42.8mg,如果用该食盐替代碘片提供治疗辐射所需的碘元素,则每日需食用该食盐的质量为________kg.
(1)l31 I原子中含有53个质子,78个中子。
①l31 I原子的核外电子数为________。
②自然界中普遍存在另一种稳定的碘原子l27I,它和131I同属于碘元素。l27I原子的质子数为__________
(2)专家指出,服用碘片(有效成分为KI)可以治疗131I造成的辐射,但服用碘酒(有效成分为I2)却会引起碘中毒。KI和I2的性质不同的原因是________________。
(3)日本地震后,个别居民抢购食盐。假设某人经医生确认,每日需要补充166mgKI。已知每千克某品牌碘盐中KIO3的加入量为42.8mg,如果用该食盐替代碘片提供治疗辐射所需的碘元素,则每日需食用该食盐的质量为________kg.
(1)①53 ②53
(2)构成物质的分子不同
(3)5
(2)构成物质的分子不同
(3)5
本题考查的是原子的有关数量计算,元素的概念,元素的质量分数计算,化合物中某元素的质量计算。
(1)①根据在原子中,核内质子数=核外电子数,由于131I原子中含有53个质子,所以131I原子的核外电子数为53;
②同种元素的原子的质子数相同,131I原子中含有53个质子,所以127I原子的质子数为53;
(2)物质的结构决定物质的性质,碘酒中的碘是由碘分子构成的,KI中的碘是碘离子,构成物质的微粒不同,所以,KI和I2的性质不同;
(3)因为物质中元素的质量分数=该元素相对原子质量之和/该物质的相对分子质量 ×100%,所以KI中碘元素的质量分数=127/166×100%=76.5%,又因为元素的质量等于物质的质量与该元素的质量分数的乘积,则166mgKI中含碘元素的质量为166mg×76.5%=127mg;如果用食盐替代碘片提供治疗辐射所需的碘元素,则碘元素的质量也应为127mg,而KIO3中I的质量分数为127/(39+127+16×3)×100%=59.3%,故需KIO3的质量为127mg÷59.3%=214mg,根据题意每千克某品牌碘盐中KIO3的加入量为42.8mg,故需食用食盐的质量为214mg÷42.8mg/1000g=5000g=5kg
(1)①根据在原子中,核内质子数=核外电子数,由于131I原子中含有53个质子,所以131I原子的核外电子数为53;
②同种元素的原子的质子数相同,131I原子中含有53个质子,所以127I原子的质子数为53;
(2)物质的结构决定物质的性质,碘酒中的碘是由碘分子构成的,KI中的碘是碘离子,构成物质的微粒不同,所以,KI和I2的性质不同;
(3)因为物质中元素的质量分数=该元素相对原子质量之和/该物质的相对分子质量 ×100%,所以KI中碘元素的质量分数=127/166×100%=76.5%,又因为元素的质量等于物质的质量与该元素的质量分数的乘积,则166mgKI中含碘元素的质量为166mg×76.5%=127mg;如果用食盐替代碘片提供治疗辐射所需的碘元素,则碘元素的质量也应为127mg,而KIO3中I的质量分数为127/(39+127+16×3)×100%=59.3%,故需KIO3的质量为127mg÷59.3%=214mg,根据题意每千克某品牌碘盐中KIO3的加入量为42.8mg,故需食用食盐的质量为214mg÷42.8mg/1000g=5000g=5kg

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
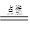 2H2O,正确的读法是
2H2O,正确的读法是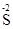 O4)3中化学式上方的“一2”表示3个硫酸根的化合价为一2价
O4)3中化学式上方的“一2”表示3个硫酸根的化合价为一2价