题目内容
(2012?扬州)某化工厂为综合利用FeSO4,设计了以下工艺流程:

煅烧炉1中发生的部分化学反应有:FeCO3
FeO+CO2↑ C+CO2
2CO
(1)煤粉、H2既是重要的化工原料又是重要的能源,氢氧燃料电池可以将
(2)煅烧炉1中还会发生FeO和CO反应,其方程式为
(3)下列金属能从FeSO4溶液中置换出Fe的是
a、Al b、Cu c、Ag
(4)实验室模拟操作a 的过程是蒸发浓缩、
(5)请设计实验证明(NH4)SO4是铵态氮肥

煅烧炉1中发生的部分化学反应有:FeCO3
| ||
| ||
(1)煤粉、H2既是重要的化工原料又是重要的能源,氢氧燃料电池可以将
化学
化学
能转化为电能,煤燃烧主要讲化学能转化为热
热
能.(2)煅烧炉1中还会发生FeO和CO反应,其方程式为
FeO+CO
Fe+CO2
| ||
FeO+CO
Fe+CO2
,X气体的化学式是
| ||
CO2
CO2
;循环利用X的优点是减少温室气体的排放,降低生产成本
减少温室气体的排放,降低生产成本
.(3)下列金属能从FeSO4溶液中置换出Fe的是
a
a
(填字母)a、Al b、Cu c、Ag
(4)实验室模拟操作a 的过程是蒸发浓缩、
降温结晶
降温结晶
、过滤干燥.(5)请设计实验证明(NH4)SO4是铵态氮肥
| 实验步骤 | 实验现象 | 实验结论 |
取适量样品,放入研钵中,加入少量消石灰,用研杵研磨 取适量样品,放入研钵中,加入少量消石灰,用研杵研磨 |
闻到有刺激性气味 闻到有刺激性气味 |
样品为铵态氮肥 |
分析:(1)依据能量的转化知识分析解答;
(2)依据一氧化碳具有还原性书写化学反应方程式;依据煅烧炉的反应分析X的物质种类,依据温室效应的相关知识以及生产成本分析二氧化碳循环利用的优点;
(3)依据金属与盐溶液的反应的一般规律分析解答;
(4)从降温结晶的过程分析获得硫酸铵晶体的方法;
(5)依据铵盐遇碱会生成氨气的性质分析解答即可;
(2)依据一氧化碳具有还原性书写化学反应方程式;依据煅烧炉的反应分析X的物质种类,依据温室效应的相关知识以及生产成本分析二氧化碳循环利用的优点;
(3)依据金属与盐溶液的反应的一般规律分析解答;
(4)从降温结晶的过程分析获得硫酸铵晶体的方法;
(5)依据铵盐遇碱会生成氨气的性质分析解答即可;
解答:解:(1)根据反应的过程可知氢氧燃料电池可以将化学能转化为电能,煤燃烧主要讲化学能转化为热能;
(2)一氧化碳具有还原性能还原氧化亚铁生成铁和二氧化碳,其方程式为:FeO+CO
Fe+CO2;所以可知X是二氧化碳,二氧化碳是温室气体所以二氧化碳的循环利用不但可以减少温室气体的排放,而且也可降低生产成本;
(3)金属与盐溶液的反应的一般规律是:活动性强的金属可以把活动性比它弱的金属从其盐溶液中置换出来,由于提供的金属中只有铝的活动性比铁强.所以铝可以置换出硫酸亚铁中的铁;
(4)操作a是把硫酸铵从溶液中结晶析出,所以操作步骤应该是蒸发浓缩,降温结晶和干燥过滤;
(5)由于铵盐遇碱会生成氨气,所以可设计硫酸铵与消石灰共同研磨,从产生刺激性气味分析设计;
故答案为:(1)电能;热能;
(2)FeO+CO
Fe+CO2;CO2;减少温室气体的排放,降低生产成本;
(3)a;
(4)降温结晶;
(5)(其它合理答案也可)
(2)一氧化碳具有还原性能还原氧化亚铁生成铁和二氧化碳,其方程式为:FeO+CO
| ||
(3)金属与盐溶液的反应的一般规律是:活动性强的金属可以把活动性比它弱的金属从其盐溶液中置换出来,由于提供的金属中只有铝的活动性比铁强.所以铝可以置换出硫酸亚铁中的铁;
(4)操作a是把硫酸铵从溶液中结晶析出,所以操作步骤应该是蒸发浓缩,降温结晶和干燥过滤;
(5)由于铵盐遇碱会生成氨气,所以可设计硫酸铵与消石灰共同研磨,从产生刺激性气味分析设计;
故答案为:(1)电能;热能;
(2)FeO+CO
| ||
(3)a;
(4)降温结晶;
(5)(其它合理答案也可)
| 实验步骤 | 实验现象 | 实验结论 |
| 取适量样品,放入研钵中,加入少量消石灰,用研杵研磨 | 闻到有刺激性气味 | 样品为铵态氮肥 |
点评:结合流程设计的目的制备硫酸铵,分析流程中所发生的反应,完成对流程的正确认识,此乃解答该问题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
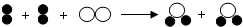 (
(  、
、 代表不同原子),关于该反应的说法正确的是( )
代表不同原子),关于该反应的说法正确的是( )
