题目内容
(一)某工厂以流量为Q1排出含硫酸a%的工业废水,现在往该废水中注入含氢氧化钠b%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,求氢氧化钠溶液的流量Q2(结果用分式表示).(已知:Q1、Q2代表单位时间流经溶液的体积,且含酸废水的密度和含碱废水的密度均为ρ)
(备用)(必要时用于提高难度))
(二)东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 加入氯化钡溶液质量(g) | 15 | 20 | 25 | 30 |
| 反应得到沉淀的质量(g) | 1.40 | 1.86 | 2.33 | 2.33 |
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)
解:设时间为t.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
Q2tρ b% Q1tρa%
80:98=Q2tρ b%:Q1tρa%,
Q2=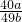 Q1.
Q1.
答:氢氧化钠溶液的流量为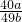 Q1.
Q1.
设25g氯化钡溶液中氯化钡质量为x,5g混合物中硫酸钠质量为y
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 208 233
y x 2.33g
142:233=y:2.33g 解之得 y=1.42g
208:233=x:2.33g 解之得 x=2.08g
未知氯化钡溶液的质量分数=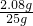 ×100%=8.32%
×100%=8.32%
原混合物中硫酸钠的质量分数是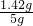 ×100%=28.4%
×100%=28.4%
答:(1)未知氯化钡溶液的质量分数为8.32%;
(2)原混合物中硫酸钠的质量分数为28.2%.
分析:要使处理后的废水pH约为7,即氢氧化钠与硫酸恰好完全反应;一段时间内排出废水的质量=ρ?v=ρQt;
根据加入20g氯化钡溶液生成1.86g沉淀,沉淀质量大于加入15g氯化钡溶液时所产生沉淀质量,据此可判断加入15g氯化钡溶液时,混合溶液中的硫酸钠未完全反应,则向混合溶液中加入氯化钡溶液完全反应可生成硫酸钡沉淀质量比=15g:1.40g;按此质量关系,若分别加入25g、30g氯化钡溶液完全反应,应得到硫酸钡沉淀为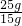 ×1.40g≈2.33g、
×1.40g≈2.33g、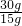 ×1.40g=2.80g,而根据实际实验中所得硫酸钡质量可知,当加入25g氯化钡溶液时,混合物中硫酸钠恰好完全反应.
×1.40g=2.80g,而根据实际实验中所得硫酸钡质量可知,当加入25g氯化钡溶液时,混合物中硫酸钠恰好完全反应.
点评:根据氯化钡完全反应时计算所加氯化钡溶液中溶质质量分数,因此在计算氯化钡溶液溶质质量分数时,不能选择未完全反应的第四次实验中的数据进行计算.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
Q2tρ b% Q1tρa%
80:98=Q2tρ b%:Q1tρa%,
Q2=
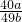 Q1.
Q1.答:氢氧化钠溶液的流量为
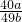 Q1.
Q1.设25g氯化钡溶液中氯化钡质量为x,5g混合物中硫酸钠质量为y
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 208 233
y x 2.33g
142:233=y:2.33g 解之得 y=1.42g
208:233=x:2.33g 解之得 x=2.08g
未知氯化钡溶液的质量分数=
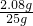 ×100%=8.32%
×100%=8.32%原混合物中硫酸钠的质量分数是
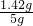 ×100%=28.4%
×100%=28.4%答:(1)未知氯化钡溶液的质量分数为8.32%;
(2)原混合物中硫酸钠的质量分数为28.2%.
分析:要使处理后的废水pH约为7,即氢氧化钠与硫酸恰好完全反应;一段时间内排出废水的质量=ρ?v=ρQt;
根据加入20g氯化钡溶液生成1.86g沉淀,沉淀质量大于加入15g氯化钡溶液时所产生沉淀质量,据此可判断加入15g氯化钡溶液时,混合溶液中的硫酸钠未完全反应,则向混合溶液中加入氯化钡溶液完全反应可生成硫酸钡沉淀质量比=15g:1.40g;按此质量关系,若分别加入25g、30g氯化钡溶液完全反应,应得到硫酸钡沉淀为
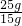 ×1.40g≈2.33g、
×1.40g≈2.33g、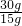 ×1.40g=2.80g,而根据实际实验中所得硫酸钡质量可知,当加入25g氯化钡溶液时,混合物中硫酸钠恰好完全反应.
×1.40g=2.80g,而根据实际实验中所得硫酸钡质量可知,当加入25g氯化钡溶液时,混合物中硫酸钠恰好完全反应.点评:根据氯化钡完全反应时计算所加氯化钡溶液中溶质质量分数,因此在计算氯化钡溶液溶质质量分数时,不能选择未完全反应的第四次实验中的数据进行计算.

练习册系列答案
相关题目
(一)某工厂以流量为Q1排出含硫酸a%的工业废水,现在往该废水中注入含氢氧化钠b%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,求氢氧化钠溶液的流量Q2(结果用分式表示).(已知:Q1、Q2代表单位时间流经溶液的体积,且含酸废水的密度和含碱废水的密度均为ρ)
(备用)(必要时用于提高难度))
(二)东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
若有关的化学反应为:Na2SO4+BaCl2=BaSO4↓+2NaCl,请计算:
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)
(备用)(必要时用于提高难度))
(二)东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 加入氯化钡溶液质量(g) | 15 | 20 | 25 | 30 |
| 反应得到沉淀的质量(g) | 1.40 | 1.86 | 2.33 | 2.33 |
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)
(一)某工厂以流量为Q1排出含硫酸a%的工业废水,现在往该废水中注入含氢氧化钠b%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,求氢氧化钠溶液的流量Q2(结果用分式表示).(已知:Q1、Q2代表单位时间流经溶液的体积,且含酸废水的密度和含碱废水的密度均为ρ)
(备用)(必要时用于提高难度))
(二)东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
若有关的化学反应为:Na2SO4+BaCl2=BaSO4↓+2NaCl,请计算:
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)
(备用)(必要时用于提高难度))
(二)东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 加入氯化钡溶液质量(g) | 15 | 20 | 25 | 30 |
| 反应得到沉淀的质量(g) | 1.40 | 1.86 | 2.33 | 2.33 |
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)