题目内容
密闭容器内,将少量乙醇(化学式C2H5OH)置于一定量氧气中燃烧,生成二氧化碳、水蒸汽和一种未知物质W。现测得反应前后各物质的质量如下:
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | W |
| 反应前质量/g | 48 | 80 | 0 | 0 | 0 |
| 反应后质量/g | 2 | 0 | 44 | 54 | X |
下列说法错误的是
A.W物质一定含有氧元素 B.该反应属于氧化反应
C.W物质一定含有氢元素 D.表中X的值为28
C
解析试题分析:从表中信息可知参加反应的乙醇的质量是:48g-2g=46g,参加反应的氧气是80g,生成二氧化碳的质量是44g,生成水的质量是54g,则生成w的质量是:46g+80g-44g-54g=28g,D对;该反应是乙醇与氧气的反应,属于氧化反应,B对;46g乙醇(C2H5OH)中含有氧元素的质量是:46g×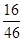 ×100%=16g,含有氢元素的质量是:46g×
×100%=16g,含有氢元素的质量是:46g×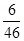 ×100%=6g;44g二氧化碳中含有氧元素的质量是:44g×
×100%=6g;44g二氧化碳中含有氧元素的质量是:44g×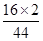 ×100%=32g;54g水中氢元素的质量是:54g×
×100%=32g;54g水中氢元素的质量是:54g×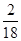 ×100%=6g,氧元素的质量是54g-6g=48g;由于反应物乙醇中氢元素的质量与生成物中水中氢元素的质量相等,所以w中一定不含有氢元素,C错;又因为参加反应的乙醇和氧气中氧元素的质量和:16g+80g=96g大于生成的二氧化碳和水中氧元素的质量和:32g+48g=80g,故w中一定含有氧元素,A对。
×100%=6g,氧元素的质量是54g-6g=48g;由于反应物乙醇中氢元素的质量与生成物中水中氢元素的质量相等,所以w中一定不含有氢元素,C错;又因为参加反应的乙醇和氧气中氧元素的质量和:16g+80g=96g大于生成的二氧化碳和水中氧元素的质量和:32g+48g=80g,故w中一定含有氧元素,A对。
考点:质量守恒定律,根据化学式的计算。

常用的消毒剂有氯气(Cl2)、二氧化氯(ClO2)、漂白粉[Ca(ClO)2]等,这三种物质都含有
| A.原子团 | B.氯分子 | C.氯离子 | D.氯元素 |
据报道,“毒淀粉”是在淀粉中添加了对人体有害的马来酸(C4H4O4)。马来酸是无色晶体,能溶于水。下列关于马来酸的说法中正确的是
| A.马来酸属于氧化物 |
| B.马来酸中氧元素的质量分数最大 |
| C.马来酸中碳、氢、氧三种元素的质量比为1:1:1 |
| D.5%的马来酸溶液中氧元素的质量分数为2.76% |
下列化学反应中属于吸热反应的是
| A.CaO + H2O=Ca(OH)2 |
B.CO2 + C 2CO 2CO |
C.C2H5OH+3O2 2CO2+3H2O 2CO2+3H2O |
| D.Mg+ H2SO4=MgSO4 + H2↑ |
熟石灰可改良酸性土壤,但不能与铵态氮肥混合使用,其原因是两者混合会发生化学反应:Ca(OH)2+2NH4Cl—2X↑+CaCl2 +2H2O,则X的化学式为
| A.NH3 | B.NO | C.NO2 | D.N2 |
高铁酸钾〔K2FeO4〕是一种具有氧化、吸附、凝聚、杀菌等功能的新型、高效水处理剂。它与水反应的化学方程式为:4 K2FeO4+10H2O=4Fe(OH)3↓+8X+3O2↑,则X的化学式为( )
| A.K2O | B.KOH | C.K | D.KH |
高铁酸钠(Na2FeO4)是一种“绿色环保高效”的饮用水消毒剂。高铁酸钠中铁元素的化合价为
| A.+2 | B.+3 | C.+5 | D.+6 |
冲洗照片时,需将底片浸泡在大苏打(Na2S2O3)溶液中,使影像固定下来,这一过程叫“定影”.大苏打中硫元素的化合价为( )
| A.0 | B.+2 | C.+4 | D.+6 |