��Ŀ����
����Ŀ��Na2CO3��NaHCO3�������г������Σ�ijʵ��С��ͨ������ʵ�����о����������ʵ����ʣ���֪��Na2CO3��NaHCO3��ˮ��Һ�ʼ��ԣ�NaHCO3�����ֽ�����Na2CO3��H2O��CO2����
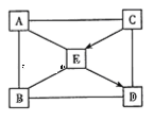
��1����ȡ���ֹ����1g�ֱ������֧�Թ��У��ټ���5mLˮ�����������ܽ⣬���ָ������£�
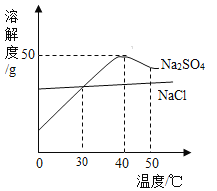
�ٷ���Na2CO3��ȫ�ܽ⣬��NaHCO3��ʣ�࣮�ɴ˵ó����ۣ�����ͬ�¶��£� ��
����������Һ�и�����1��2�η�̪��Һ����Һ���� ɫ��
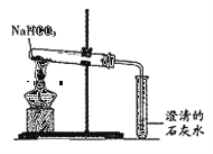
��2����ȡ����NaHCO3����ͼװ�ý���ʵ�飬�ɹ۲���������ǣ����Թܿ���ˮ�����ɣ� ��
���� �ķ�����ȥ����Na2CO3��ĩ��������NaHCO3��
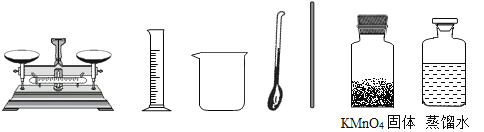
��3���ⶨNa2CO3��Ʒ����NaCl���ʣ���Na2CO3������������
�ٳ�ȡmg��Ʒ�����ձ��м�ˮ�ܽ⣻
�ڼ��������CaCl2��Һ��ַ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ ��֤����Ӧ��CaCl2��ʣ��ķ����� ��
�۹��ˡ�ϴ�ӡ���������ⶨ������Ϊng������Ʒ��Na2CO3����������Ϊ ��
���𰸡���1����ͬ���������ֹ�����ͬ������ܼ��У�Na2CO3��NaHCO3������ˮ���ں죻
��2���ٳ���ʯ��ˮ����ǣ��ڼ���
��3����Na2CO3+CaCl2=CaCO3��+2NaCl �ټ���̼���ƣ��а�ɫ�������ɣ�
��![]() ��100%
��100%
��������
���������
��1������ͬ���¶��£����������ܼ����ܽ��̼���Ƶ���������˵�����¶��£�Na2CO3��NaHCO3������ˮ��
������̼���ƺ�̼�����Ƶ���Һ���Լ��ԣ�����������Һ�и�����η�̪��Һ����Һ���ʺ�ɫ��
��2���ٸ������ϣ���NaHCO3�����ֽ�����Na2CO3��H2O��CO2�����ʿɹ۲���������ǣ����Թܿ���ˮ�����ɣ����ɵ�CO2����ͨ�����ʯ��ˮ������ʯ��ˮ����ǣ�
������̼���Ƽ��Ȳ��ֽ⣬̼�����������ֽ⣬�ʿ��ü��ȵķ�����ȥ����Na2CO3��ĩ��������NaHCO3��
��3����̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ�Na2CO3+CaCl2=CaCO3��+2NaCl��֤����Ӧ��CaCl2��ʣ��ķ������ټ���̼���ƣ��а�ɫ�������ɣ�
�����û�ѧ����ʽ�����ݷ�Ӧ�������ȼ��ɼ����̼���Ƶ�������
��̼������Ʒ��̼���Ƶ�����Ϊx��
Na2CO3+CaCl2=CaCO3��+2NaCl
106 100
x ng
![]()
x=![]() g
g
��Ʒ��Na2CO3����������Ϊ![]() ��100%=
��100%=![]() ��100%
��100%

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�