题目内容
计算题:
现有含少量不溶性质的CuO样品10.6g,向其中加入92g稀硫酸微热,恰好完全反应(杂质不参加反应).过滤,洗涤,留在滤纸上的不溶性质杂质经干燥后,称其质量为2.6g,并得到CuSO4溶液(滤液).求:
(1)样品中CuO的质量:
(2)反应后得所得CuS04溶液中溶质质量分数.
解:(1)样品中氧化铜的质量为10.6g-2.6g=8g
(2)设生成硫酸铜的质量为x.
CuO+H2SO4=CuSO4+H2O
80 160
8g x
 =
= ,x=16g
,x=16g
所得硫酸铜溶液中溶质质量分数为
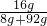 ×100%=16%
×100%=16%
答:(1)样品中氧化铜的质量为8g;
(2)所得硫酸铜溶液中溶质质量分数为16%.
分析:(1)样品质量去掉杂质质量就是氧化铜的质量;
(2)根据化学方程式由氧化铜的质量可计算出硫酸铜的质量,再根据溶质质量分数的计算公式可计算出所得硫酸铜溶液中溶质质量分数.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较小.
(2)设生成硫酸铜的质量为x.
CuO+H2SO4=CuSO4+H2O
80 160
8g x
 =
= ,x=16g
,x=16g所得硫酸铜溶液中溶质质量分数为
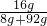 ×100%=16%
×100%=16%答:(1)样品中氧化铜的质量为8g;
(2)所得硫酸铜溶液中溶质质量分数为16%.
分析:(1)样品质量去掉杂质质量就是氧化铜的质量;
(2)根据化学方程式由氧化铜的质量可计算出硫酸铜的质量,再根据溶质质量分数的计算公式可计算出所得硫酸铜溶液中溶质质量分数.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较小.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目