题目内容
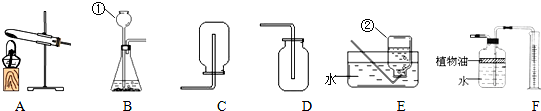
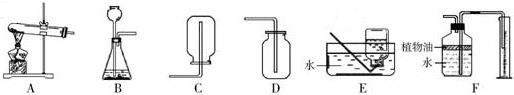
如图所示为实验室常用的实验装置:
据此回答下列问题:
(1)实验室制取和收集CO2时应选用 两种装置相连接,反应的化学方程式为 ,检验集气瓶中CO2是否收集满的方法是 .
(2)F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是 .
(3)实验室用KMnO4制取O2时,可选用的发生装置是 ,反应的化学方程式为 .
(4)在一个大烧杯里加入一定量的石灰石和一定量的稀盐酸,反应后,烧杯内剩余物的质量比原来石灰石和稀盐酸的质量总和减少了2.2g,那么参加反应的碳酸钙的质量为多少?

据此回答下列问题:
(1)实验室制取和收集CO2时应选用
(2)F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是
(3)实验室用KMnO4制取O2时,可选用的发生装置是
(4)在一个大烧杯里加入一定量的石灰石和一定量的稀盐酸,反应后,烧杯内剩余物的质量比原来石灰石和稀盐酸的质量总和减少了2.2g,那么参加反应的碳酸钙的质量为多少?
分析:(1)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳不能燃烧,不支持燃烧;
(2)二氧化碳能够溶于水,不溶于植物油;
(3)高锰酸钾受热时容易扩散,分解能生成锰酸钾、二氧化锰和氧气;
(4)根据反应前后的质量差可以计算生成二氧化碳的质量,根据二氧化碳的质量和反应的化学方程式,可以计算参加反应的碳酸钙的质量.
二氧化碳不能燃烧,不支持燃烧;
(2)二氧化碳能够溶于水,不溶于植物油;
(3)高锰酸钾受热时容易扩散,分解能生成锰酸钾、二氧化锰和氧气;
(4)根据反应前后的质量差可以计算生成二氧化碳的质量,根据二氧化碳的质量和反应的化学方程式,可以计算参加反应的碳酸钙的质量.
解答:解:(1)实验室制取二氧化碳时不需要加热,应该用B装置作为发生装置;
二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
检验集气瓶中二氧化碳是否收集满的方法是:把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满.
故填:B和D;CaCO3+2HCl═CaCl2+H2O+CO2↑;把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满.
(2)为了防止二氧化碳溶于水影响实验结果,通过在水面上覆盖一层植物油.
故填:防止二氧化碳溶于水.
(3)实验室用高锰酸钾制取氧气时需要加热,应该用A装置作为发生装置;
高锰酸钾受热分解的化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑.
故填:A;2KMnO4
K2MnO4+MnO2+O2↑.
(4)解:设参加反应的碳酸钙的质量为x,
反应后,烧杯内剩余物的质量比原来石灰石和稀盐酸的质量总和减少了2.2g,说明反应生成了2.2g二氧化碳;
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 2.2g
=
,
x=5g,
答:参加反应的碳酸钙的质量为5g.
二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
检验集气瓶中二氧化碳是否收集满的方法是:把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满.
故填:B和D;CaCO3+2HCl═CaCl2+H2O+CO2↑;把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满.
(2)为了防止二氧化碳溶于水影响实验结果,通过在水面上覆盖一层植物油.
故填:防止二氧化碳溶于水.
(3)实验室用高锰酸钾制取氧气时需要加热,应该用A装置作为发生装置;
高锰酸钾受热分解的化学方程式为:2KMnO4
| ||
故填:A;2KMnO4
| ||
(4)解:设参加反应的碳酸钙的质量为x,
反应后,烧杯内剩余物的质量比原来石灰石和稀盐酸的质量总和减少了2.2g,说明反应生成了2.2g二氧化碳;
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 2.2g
| 100 |
| 44 |
| x |
| 2.2g |
x=5g,
答:参加反应的碳酸钙的质量为5g.
点评:本题主要考查实验装置的选择,化学方程式的书写,根据化学方程式计算,计算时要注意规范性和准确性.

练习册系列答案
相关题目