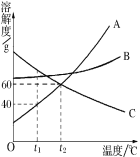
题目内容
【题目】某工厂排出的废水中含有Na2CO3,为测得其含量化学兴趣小组取该废水100g,向其中加入19.2g稀盐酸,恰好完全反应(其他杂质不与盐酸反应,气体全部逸出)得到117g溶液。试计算:
(1)反应后生成CO2的质量为 g。
(2)原废水中Na2CO3的质量分数;反应后所得溶液的质量分数。(请写出计算过程)
【答案】(1)2.2克(2)5.3% ; 5%
【解析】
试题分析:解:根据质量守恒定律可以知道反应生成CO2气体的质量为:100g+19.2g﹣117g=2.2g。
设生成氯化钠的质量为x,原废水中Na2CO3的质量为y
Na2CO3+2HC1═2NaC1+H2O+CO2↑,(1分)
106 117 44
y x 2.2g
![]() =
=![]() , 106:y=44:2.2
, 106:y=44:2.2
x=5.85g,(1分) y=5.3 g
反应后所得溶液中溶质的质量分数为:![]() ×100%=5%,
×100%=5%,
废水中Na2CO3的质量分数为5.3 g∕100 g ×100%=5.3%

练习册系列答案
相关题目