题目内容
(2012?武侯区模拟)10g铜锌合金与90g(足量)稀硫酸反应后,固、液混合物质量为99.8g,试计算合金中铜的质量分数.
分析:因为铜的金属活动性在(H)后,故铜不能与稀硫酸发生置换反应.因此,合金中只有锌和稀硫酸发生反应放出氢气.质量减少的为氢气的质量;根据反应的化学方程式和生成的氢气的质量,列出比例式,即可计算出合金中锌的质量.然后根据质量分数公式计算即可.
解答:解:设合金中锌的质量为x,其中氢气的质量=10g+90g-99.8g=0.2g
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
=
x=6.5g
合金中铜的质量为:10g-6.5g=3.5g
计算合金中铜的质量分数=
×100%=35%.
答:合金中铜的质量分数为35%.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
| 65 |
| x |
| 2 |
| 0.2g |
x=6.5g
合金中铜的质量为:10g-6.5g=3.5g
计算合金中铜的质量分数=
| 3.5g |
| 10g |
答:合金中铜的质量分数为35%.
点评:本题主要考查学生运用化学方程式和质量分数公式解答问题的能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
 (2012?武侯区模拟)府南河是我们的母亲河,某中学研究性学习小组对府南河水质的状况进行相关的调查研究.
(2012?武侯区模拟)府南河是我们的母亲河,某中学研究性学习小组对府南河水质的状况进行相关的调查研究.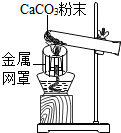 (2012?武侯区模拟)小林、小军和小明在实验室用如图装置做CaCO3受热分解的实验,加热一段时间后,他们对试管内固体的成分进行探究.
(2012?武侯区模拟)小林、小军和小明在实验室用如图装置做CaCO3受热分解的实验,加热一段时间后,他们对试管内固体的成分进行探究.