题目内容
【题目】现有下列装置,回答问题:

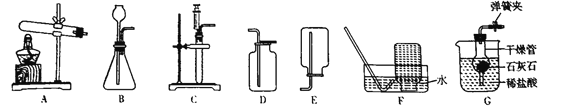
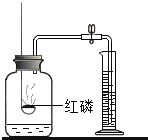
(1)能完成实验室制取二氧化碳气体的装置是______和______(填数字);
(2)实验室制取二氧化碳气体的化学方程式是______;
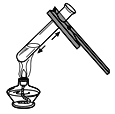
(3)能完成高锰酸钾制取并收集干燥氧气的装置是______和_______(填数字),实验室用高锰酸钾制取氧气的化学方程式为______;
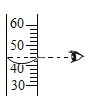
(4)将一定质量的高锰酸钾加热分解一段时间后,所得固体剩余物中Mn、O元素的质量比可能为______.
A 55:64 B 55:48 C 1:1 D 55:32
【答案】② ④ CaCO3+2HCl=CaCl2+H2O+CO2↑ ① ④ ![]() B C
B C
【解析】
(1)实验室制取二氧化碳的药品一般是石灰石和稀盐酸,反应物是固体和液体,不需要加热,所以发生装置选择②,因为二氧化碳能溶于水,不能用排水法收集,密度比空气大,可用向上排空气法,所以收集装置选择④。因此能完成实验室制取二氧化碳气体的装置是②和④;
(2)石灰石的主要成分是碳酸钙,实验室制取二氧化碳气体的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)高锰酸钾制氧气,高锰酸钾是固体,反应条件是加热,所以发生装置选择①,因为氧气不易溶于水,可用排水法收集,氧气密度比空气略大,也可用向上排空气法收集,但题中要求收集干燥氧气,所以收集装置选择④,因此能完成高锰酸钾制取并收集干燥氧气的装置是①和④。实验室用高锰酸钾制取氧气的化学方程式为:![]() ;
;
(4)高锰酸钾的化学式是:KMnO4,如果高锰酸钾不分解,其中Mn、O元素的质量比为:55∶16×4=55∶64;如果高锰酸钾完全分解,则固体剩余物中Mn、O元素的质量比为:55×2∶16×6=55∶48;将一定质量的高锰酸钾加热分解一段时间后,高锰酸钾应该是部分分解或完全分解,因此所得固体剩余物中Mn、O元素的质量比可能为:55∶64至55∶48之间包括55∶48,不包括55∶64。故选B C。

【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究二氧化锰能否加快过氧化氢分解 | 探究石蜡燃烧后是否有二氧化碳生成 | 检验氧气是否集满 | 测定空气中氧气的含量 |
A. A B. B C. C D. D
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验装置 |
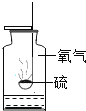
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氧气 |
主要作用 | 集气瓶中的水:吸收反应放出的热量及生成的气体 | 量筒中的水:通过体积变化得出空气中O2的体积分数 | 集气瓶中的水:冷却溅落的熔融物,防止集气瓶炸裂 | 集气瓶中预先充满的水:便于观察O2何时收集满 |
选项 | A | B | C | D |
A. AB. BC. CD. D