题目内容
【题目】今年化学实验考查内容是“配制一定溶质质量分数的氯化钠溶液”,如现在需要配制50g溶质质量分数为8%的氯化钠溶液,请回忆实验过程,回答下列问题:
I、配制溶液:
(1)计算:配制50g溶质质量分数为8%的氯化钠溶液需要氯化钠_____g,水_____mL。
(2)称量量取:用托盘天平称量所需的氯化钠时,发现天平的指针偏向左盘,应_____。
A 增加适量氯化钠固体
B 减少适量氯化钠固体
C 调节平衡螺母
(3)溶解:将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是_____。
(4)装瓶并贴上标签。
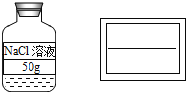
小明同学所贴标签有不妥之处,如图所示,请在右侧的空白标签上填写正确内容_____;
(5)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是_____。
A 用量筒量取水时俯视读数
B 烧杯用蒸馏水润洗后未等晾干就配制溶液
C 天平指针偏右就开始称量
D 转移已配好的溶液时,有少量溶液溅出
E 所用氯化钠晶体未充分干燥
F 转移已称好的氯化钠固体时,部分洒落在烧杯外
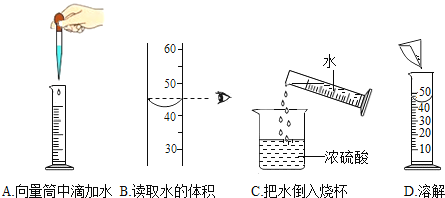
(6)在实验中,老师观察到了同学们使用量筒的下列操作,其中正确的是_____。(填序号)
II、已知20℃时氯化钠的溶解度为36g,将该50g溶液转化为20℃的氯化钠饱和溶液,最简单的方法是_____。(列式计算说明)
III、电解饱和食盐水可以得到多种化工产品,主要过程如下:
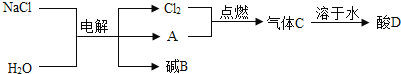
①气体A是密度最小的气体,该气体的名称为_____,写出一个由酸D转化为气体A的化学方程式_____。
②电解后生成的碱B的化学式为_____,你猜想的依据是_____。
【答案】4 46 B 加速氯化钠溶解 ![]() BEF A 加入12.56g氯化钠固体,搅拌使其溶解 氢气
BEF A 加入12.56g氯化钠固体,搅拌使其溶解 氢气 ![]() NaOH 化学反应前后元素种类不变
NaOH 化学反应前后元素种类不变
【解析】
I(1)配制50g溶质质量分数为8%的氯化钠溶液需要氯化钠的质量为![]() ;需水的体积为
;需水的体积为![]() 。
。
(2)用托盘天平称量所需的氯化钠时,发现天平的指针偏向左盘,说明氯化钠超量应适量减少氯化钠固体,故选B。
(3)溶解时玻璃棒的作用加速氯化钠溶解。
(4)溶液试剂瓶标签应出示什么溶液和浓度大小,故空白标签上填写正确内容为![]() 。
。
(5)A、用量筒量取水时俯视读数,读数偏大,实际量取水的体积偏小,配制所得的氯化钠溶液中氯化钠的质量分数偏大,故A不正确;
B、烧杯用蒸馏水润洗后未等晾干就配制溶液,溶剂的质量变大,溶液质量变大,配制所得的氯化钠溶液中氯化钠的质量分数偏小,故B正确;
C、天平指针偏右就开始称量,溶质质量变大,配制所得的氯化钠溶液中氯化钠的质量分数偏大,故C不正确;
D、转移已配好的溶液时,有少量溶液溅出,配制所得的氯化钠溶液中氯化钠的质量分数不变,故D不正确;
E、所用氯化钠晶体未充分干燥,氯化钠的质量变小,配制所得的氯化钠溶液中氯化钠的质量分数偏小,故E正确;
F、转移已称好的氯化钠固体时,部分洒落在烧杯外,氯化钠的质量变小,配制所得的氯化钠溶液中氯化钠的质量分数偏小,故F正确。
故选BEF。
(6)A、胶头滴管滴加液体要悬空垂直滴加,故A正确;
B、量筒读数时视线应与凹液面的最低处保持和水平,故B不正确;
C、量筒可以量取水,倾倒水,但是水不倒入浓硫酸,会造成液体溅出,腐蚀皮肤,故C不正确;
D、不能在量筒内配制溶液,故D不正确。故选A。
II、该溶液在20℃时不饱和,可采用加溶质的简便办法使其转化成饱和溶液。
设加入溶质质量为x
![]()
![]()
故加入12.56g氯化钠固体,搅拌使其溶解。
III、①密度最小的气体是氢气,气体A是密度最小的气体,该气体的名称为氢气;氯气和氢气点燃时生成氯化氢气体,溶于水生成盐酸,并放出热量,锌和盐酸反应生成氯化锌和氢气,反应的化学方程式为![]() 。
。
②氯化钠和水电解,根据质量守恒定律,在化学反应前后元素种类不变,反应前有钠元素、氢元素、氧元素,反应后生成碱,则碱B是氢氧化钠,化学式为![]() ,猜想的依据是化学反应前后元素种类不变。
,猜想的依据是化学反应前后元素种类不变。