题目内容
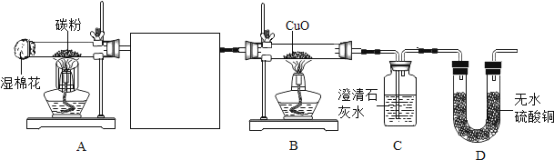
【题目】下图是实验室可能用到的气体发生装置和收集装置。回答下列问题:
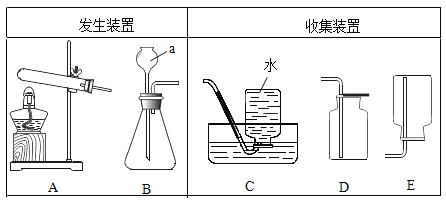
(1)写出图中仪器 a 的名称:_____。
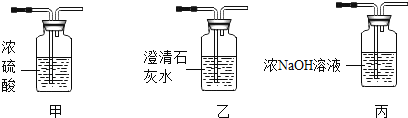
(2)某同学用加热氯酸钾和二氧化锰混合物制取并收集较纯净的O2应选用的发生装置和收集装置 是__________(填字母序号),该反应的化学方程式是_____。实验主要步骤有:①将导气管移出水槽;②加热;③装药品;④收集气体;⑤熄灭酒精灯;⑥检查装置气密性。正确的操作顺序为_____(填数字序号)。
(3)实验室制取CO2气体的化学方程式是_________。某同学 选取上图中的发生装置_____(填字母序号)与下图的装置连接并完成CO2性质的有关实验。
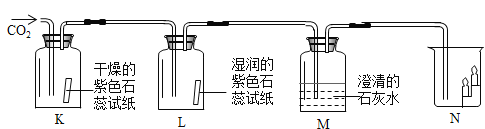
(4)设计 K、L 对比实验的目的是_____; M 装置中澄清石灰水变浑浊的化学方程式是_____;通入CO2一段时间后,N 烧杯中_________(填“上层”或“下层”)的蜡烛先熄灭。
【答案】长颈漏斗 A、C 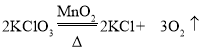 ⑥③②④①⑤
⑥③②④①⑤ ![]() B 证明二氧化碳与水反应生成酸
B 证明二氧化碳与水反应生成酸 ![]() 下层
下层
【解析】
(1)仪器 a 是长颈漏斗。
(2)用加热氯酸钾和二氧化锰混合物制取并收集较纯净的 O2 ,因为该反应原理需要加热,故发生装置应选择A;要收集较纯净的氧气,收集装置应用排水法,故选择C。该反应的化学方程式是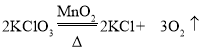 。正确的操作:先检查装置气密性,装入药品,然后给药品加热,收集气体,再将导气管移出水槽,熄灭酒精灯。
。正确的操作:先检查装置气密性,装入药品,然后给药品加热,收集气体,再将导气管移出水槽,熄灭酒精灯。
(3)实验室制取 CO2 气体是用石灰石和稀盐反应,化学方程式是![]() 。该反应原理固液不需加热,故发生装置选择B。
。该反应原理固液不需加热,故发生装置选择B。
(4)K是干燥的紫色石蕊试纸,L是湿润的紫色石蕊试纸,通过实验对比可知,干燥的紫色石蕊试纸不变色,湿润的紫色石蕊试纸变红色,证明二氧化碳能与水反应生成酸;澄清石灰水变浑浊的化学方程式是![]() ;通入 CO2 一段时间后,N 烧杯中下层的蜡烛先熄灭,因为二氧化碳不能燃烧,不支持燃烧,且密度比空气的大。
;通入 CO2 一段时间后,N 烧杯中下层的蜡烛先熄灭,因为二氧化碳不能燃烧,不支持燃烧,且密度比空气的大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】热播亲子节目<爸爸去哪儿>中几个家庭来到了零下十多度的东北雪乡.因为天气严寒,林志颖和他家的小朋友用起了“暖宝宝”取暖贴。同学们好奇取暖贴中物质的成分,于是进行了如下实验探究。
[查找资料]“暖宝宝”取暖贴中发热剂是铁粉、活性炭、可溶性无机盐、吸水性树脂(含水,树脂不参加下列实验探究中的各个反应)
[实验探究]
(探究一)为了确定“暖宝宝”取暖贴中可溶性无机盐的成分,同学们进行如下实验。
实验步骤 | 现象及结论 |
步骤1.取适量固体样品于试管中,加足量水溶解,充分搅拌,静置,过滤 | |
步骤2.取少量步骤1所得的溶液于试管中,向其中加入足量的___ | 无气泡产生 无机盐中不含碳酸钠 |
步骤3.取少量步骤2所得的溶液于试管中,向其中加入足量的Ba(NO3)2溶液 | ___ 无机盐中不含硫酸钠 |
步骤4.取少量步骤3的上层清液于试管中,向其中加入_____ | __ 无机盐中含氯化钠。 |
写出步骤4的化学方程式_____。
[反思评价] 步骤3中Ba (NO3)2溶液能否用BaCl2溶液代替__(填“能”或“不能”),理由是__。
(探究二)同学们将未使用过的“暖宝宝”取暖贴袋内物质放入过量的稀硫酸中,充分反应后过滤,滤液中的溶质是___(填化学式)
(探究三)图是同学们验证黑色粉末中含有活性炭粉的实验装置图,( 燃烧匙内盛有“暖宝宝”袋内黑色粉末,燃烧匙上方罩一个内壁涂澄清有石灰水的烧杯)
[反思评价]验证黑色粉末中是否含有活性炭的方案_ (填 “可行”或“不可行”)理由是________。
[拓展延伸]
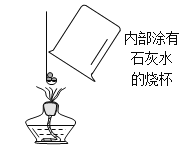
取暖贴放出的热量主要来自铁粉发生氧化(生锈)的过程将未使用的取暖贴中的黑色粉末加入右图装置广口瓶中,塞紧塞子,待冷却后打开止水夹。若____,则氧气参加了反应。
【题目】一个兴趣小组同学们在一起探究金属及金属矿物的性质,做了如下实验。
(1)探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
实验步骤 | 观察到的现象 |
①在试管中取少量盐酸,插入铜丝,充分作用。 | 无明显现象 |
②在①所得的溶液中,插入铁丝,充分作用。 | _____ |
③在②所得的溶液中插入铝丝,充分作用。 | _____ |
结论:金属活动性由强到弱的顺序_______。
(2)小明同学将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是__________________________________。
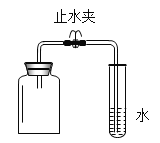
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
(交流讨论)请写出铝与盐酸反应的化学方程式:_________________________。
(分析数据)
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
实验中记录的数据可能:_______________________;对比实验②③可知____对金属与酸反应的速率有影响。
(拓展延伸1)
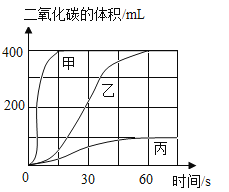
小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____________。
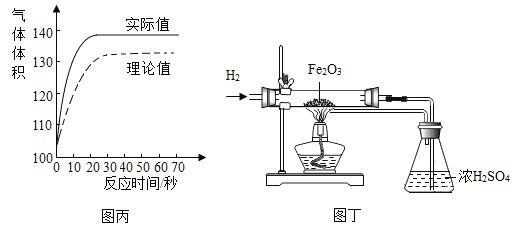
(拓展延伸2 )图丙为测得的室温下足量的铝片与20ml 10%的稀盐酸反应产生氢气的量与时间关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点)。①__________________,②________________________。
(拓展延伸3 )利用铝与盐酸产生的氢气来做下列实验,称取5.2g氧化铁样品,放入重48.48g的玻璃管中,按图丁装置连接,完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g,计算氧化铁样品中氧化铁的质量分数____________。
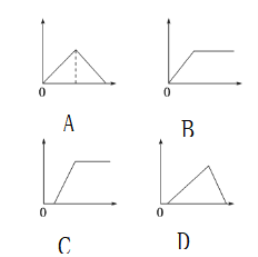
(拓展延伸4)已知氢氧化钠溶液与氢氧化铝反应,生成偏铝酸钠溶液。在铝与过量盐酸反应后的溶液中逐滴加入氢氧化钠溶液过程中现象为____(下列图像中,纵坐标为沉淀质量,横坐标为氢氧化钠溶液质量 )
【题目】下列对比实验的设计不能到达相应实验目的的是
选项 | A | B | C | D |
实验 设计 |
|
|
|
|
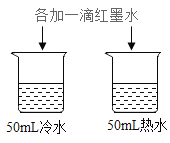
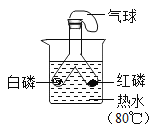
实验 目的 | 探究温度对分子运 动快慢的影响 | 探究燃烧的条件 | 探究铁、镁金属活 动性强弱 | 探 究CO2与 NaOH 溶液能否发生反应 |
A.AB.BC.CD.D