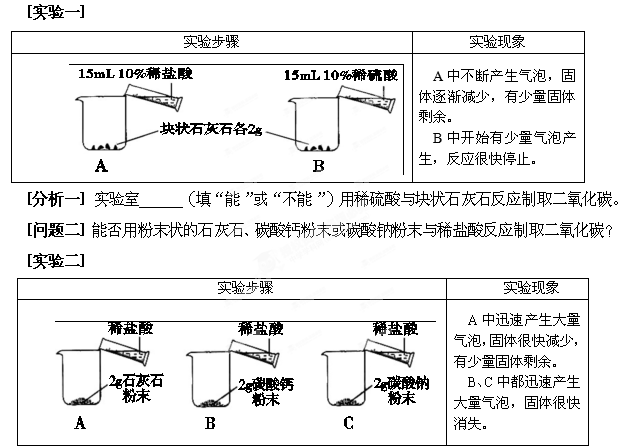
题目内容
某科学兴趣小组查阅资料得知镁可在氮气中燃烧生成氮化镁(Mg3N2),设计了如下方案进行验证。
步骤l:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,
铜丝末端固定一根镁条。
步骤2:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,
观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的1/5左右。
步骤3:往水槽中加水使广口瓶内外水面相平;点燃镁条,更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
(1)步骤2的目的是 。写出红磷在氧气中燃烧的化学方程式 ;
(2)在步骤3“待冷却后广口瓶内水位继续上升”是由于瓶内气压(选填“大于”“小于”或“等于”)外界气压。
(3)根据上述实验和你所学的知识,请写出镁在空气中燃烧时的化学方程式:①镁与氧气反应: ;②①镁与氮气反应: 。
(1)除尽空气中的氧气 4P+5O2 2P2O5 (2)小于 (3) 2Mg+O2
2P2O5 (2)小于 (3) 2Mg+O2 2MgO 3Mg+N2
2MgO 3Mg+N2 Mg3N2
Mg3N2
解析试题分析:(1)步骤2的目的是为了除尽瓶内空气中的氧气,避免对步骤3造成干扰。(2)步骤3中的镁带燃烧消耗了瓶内的氮气,使得瓶内气压小于外界大气压引起水面上升。(3)书写化学方程式时要找准找全反应物和生成物,及反应所需要的条件。
考点:空气中氧气含量测定,化学方程式的书写。

练习册系列答案
相关题目