题目内容
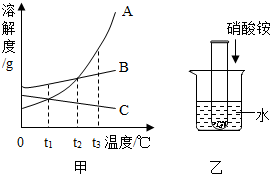 A、B、C三种物质的溶解度曲线如图甲所示.
A、B、C三种物质的溶解度曲线如图甲所示.(1)t1℃时A、B、C的溶解度由大到小的顺序是
(2)t3℃时,将等质量的A、B、C三种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为
(3)取t2℃A、B、C的饱和溶液分别降温到t1℃,所得溶液中溶质质量分数由大到小的顺序是
(4)如图乙所示试管中盛有A、B、C三种物质中某一种物质的饱和溶液,且试管底部仍有未溶的该物质,向烧杯中加入硝酸铵晶体,试管中固体逐渐减少,该物质是
分析:(1)据溶解度曲线可比较不同物质的溶解度大小;
(2)据该温度下三种物质的溶解度大小分析解答;
(3)据物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法分析解答;
(4)硝酸铵溶于水使溶液的温度降低,向烧杯中加入硝酸铵晶体,试管中固体逐渐减少,说明该物质的溶解度随温度的降低而减小,观察溶解度曲线可知该物质是C.
(2)据该温度下三种物质的溶解度大小分析解答;
(3)据物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法分析解答;
(4)硝酸铵溶于水使溶液的温度降低,向烧杯中加入硝酸铵晶体,试管中固体逐渐减少,说明该物质的溶解度随温度的降低而减小,观察溶解度曲线可知该物质是C.
解答:解:(1)t1℃时A、B、C三种物质的溶解度由大到小的顺序是B>A=C;
(2)t3℃时,A、B、C三种物质的溶解度由大到小的顺序是A、B、C,所以将等质量的A、B、C三种物质加水溶解配制成饱和溶液所需水的质量A<B<C,所得溶液质量的大小关系为A<B<C;
(3)AB的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,
所以将t2℃A、B、C的饱和溶液分别降温到t1℃,A、B的溶解度随温度降低而减小,饱和溶液会有晶体析出,溶质质量分数减小,C的溶解度随温度降低而增大,
故C溶液溶质质量分数不变,与降温前相等,
据饱和溶液中溶质质量分数的计算式
×100%,
即溶解度越大质量分数也就越大,t1℃时B的溶解度大于A大于t2℃时C的溶解度,
故所得溶液中溶质质量分数由大到小的顺序是B>A>C;
(4)由于硝酸铵溶于水时会使溶液温度降低,而该物质随着温度的降低而溶解的量会越多,故这种物质应是溶解度随温度降低而增大的C;
故答案为:(1)B>A=C;(2)A<B<C; (3)B>A>C;(4)C.
(2)t3℃时,A、B、C三种物质的溶解度由大到小的顺序是A、B、C,所以将等质量的A、B、C三种物质加水溶解配制成饱和溶液所需水的质量A<B<C,所得溶液质量的大小关系为A<B<C;
(3)AB的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,
所以将t2℃A、B、C的饱和溶液分别降温到t1℃,A、B的溶解度随温度降低而减小,饱和溶液会有晶体析出,溶质质量分数减小,C的溶解度随温度降低而增大,
故C溶液溶质质量分数不变,与降温前相等,
据饱和溶液中溶质质量分数的计算式
| 溶解度 |
| 溶解度+100g |
即溶解度越大质量分数也就越大,t1℃时B的溶解度大于A大于t2℃时C的溶解度,
故所得溶液中溶质质量分数由大到小的顺序是B>A>C;
(4)由于硝酸铵溶于水时会使溶液温度降低,而该物质随着温度的降低而溶解的量会越多,故这种物质应是溶解度随温度降低而增大的C;
故答案为:(1)B>A=C;(2)A<B<C; (3)B>A>C;(4)C.
点评:明确溶解度曲线的意义、溶质质量分数的计算方法等知识,才能结合选项正确分析解答.

练习册系列答案
相关题目
 6、下图为A、B、C三种物质的溶解度曲线,试回答下列问题:
6、下图为A、B、C三种物质的溶解度曲线,试回答下列问题: (2013?广东模拟)“
(2013?广东模拟)“ ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种物质的原子,下列关于如图说法正确的是( )
”分别表示A、B、C三种物质的原子,下列关于如图说法正确的是( )
 (2012?吴中区三模)如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(2012?吴中区三模)如图是a、b、c三种物质的溶解度曲线,回答下列问题: