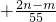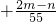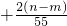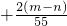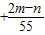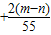题目内容
某金属氧化物的式量为m,对应氯化物的式量为n.则该金属的化合价为( )
A、+
| ||
B、+
| ||
C、+
| ||
D、+
|
分析:根据金属氧化物的式量为m,对应氯化物的式量为n,根据相对分子的质量为组成分子的各原子的相对原子质量之和,
进行分析:
设金属为R,它的化合价为x,相对分子质量为a,①当x为偶数时,氧化物的化学式为 RO
、氯化物的化学式为 RClx,
由此可得:m=a+8x n=a+35.5x 由此可求出x即为化合价;
②当x为奇数时,氧化物的化学式为 R2Ox、氯化物的化学式为 RClx,
由此可得:m=2a+16x n=a+35.5x 由此求出x即为化合价.
进行分析:
设金属为R,它的化合价为x,相对分子质量为a,①当x为偶数时,氧化物的化学式为 RO
| X |
| 2 |
由此可得:m=a+8x n=a+35.5x 由此可求出x即为化合价;
②当x为奇数时,氧化物的化学式为 R2Ox、氯化物的化学式为 RClx,
由此可得:m=2a+16x n=a+35.5x 由此求出x即为化合价.
解答:解:设金属R的化合价为x,相对分子质量为a
①当x为偶数时,氧化物的化学式为 RO
、氯化物的化学式为 RClx,
根据相对分子的质量为组成分子的各原子的相对原子质量之和,则可得:
m=a+8x
n=a+35.5x
n-m=27.5x
则 x=+
;
②当x为奇数时,氧化物的化学式为 R2Ox、氯化物的化学式为 RClx,
根据相对分子的质量为组成分子的各原子的相对原子质量之和,则可得:
m=2a+16x
n=a+35.5x
2n-m=2(a+35.5x)-2a-16x=55x
x=+
故选AC.
①当x为偶数时,氧化物的化学式为 RO
| X |
| 2 |
根据相对分子的质量为组成分子的各原子的相对原子质量之和,则可得:
m=a+8x
n=a+35.5x
n-m=27.5x
则 x=+
| 2(n-m) |
| 55 |
②当x为奇数时,氧化物的化学式为 R2Ox、氯化物的化学式为 RClx,
根据相对分子的质量为组成分子的各原子的相对原子质量之和,则可得:
m=2a+16x
n=a+35.5x
2n-m=2(a+35.5x)-2a-16x=55x
x=+
| 2n-m |
| 55 |
故选AC.
点评:本题考查学生根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行分析解题的能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目