题目内容
世纪是海洋开发与利用的世纪。我省的“十二五”规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水淡化:目前淡化海水最常用的方法是_____________▲_____________法。
(2)制盐:
①制粗盐。从卤水中提取粗盐用的结晶方法是 ▲ (“蒸发结晶”或“降温结晶”)。
②粗盐提纯。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,过滤,然后通过如下操作即可得到较纯的氯化钠:a过滤.b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是 ▲__________ (填字母)。
(3)制碱:氨碱法制纯碱的流程图如下:

①完成图中“( )”的内容:① ▲ ;② ▲ ;③ ▲ 。
②写出由NaHCO3制得Na2CO3的化学方程式:__________________▲________________。
(4)制镁:镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取,主要步骤如下:

①为了使MgCl2转化为Mg(OH)2,试剂①可选用 ▲ ,加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是______▲____ 。
②试剂②可以选用 ▲ ,反应的化学方程式为:___________▲___________。
(1)海水淡化:目前淡化海水最常用的方法是_____________▲_____________法。
(2)制盐:
①制粗盐。从卤水中提取粗盐用的结晶方法是 ▲ (“蒸发结晶”或“降温结晶”)。
②粗盐提纯。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,过滤,然后通过如下操作即可得到较纯的氯化钠:a过滤.b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是 ▲__________ (填字母)。
(3)制碱:氨碱法制纯碱的流程图如下:

①完成图中“( )”的内容:① ▲ ;② ▲ ;③ ▲ 。
②写出由NaHCO3制得Na2CO3的化学方程式:__________________▲________________。
(4)制镁:镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取,主要步骤如下:

①为了使MgCl2转化为Mg(OH)2,试剂①可选用 ▲ ,加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是______▲____ 。
②试剂②可以选用 ▲ ,反应的化学方程式为:___________▲___________。
(1)蒸馏(或多级闪急蒸馏) (2)①蒸发结晶 ②bdace
(3)①氨气(或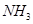 );二氧化碳(或
);二氧化碳(或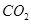 );加热(或热解)
);加热(或热解)
(4)①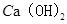 (或氢氧化钙),过滤
(或氢氧化钙),过滤
②稀盐酸,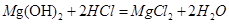
(3)①氨气(或
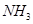 );二氧化碳(或
);二氧化碳(或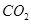 );加热(或热解)
);加热(或热解)(4)①
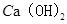 (或氢氧化钙),过滤
(或氢氧化钙),过滤②稀盐酸,
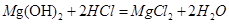
本题考查的是对海洋资源的合理开发与利用,结晶的原理、方法及其应用,粗盐的提纯的实验,酸碱盐间的相互反应。
(1)海水淡化的方法主要是将杂质除去,将水提炼出来即可,例如多级闪急蒸馏法、蒸馏法、结晶法等。
(2)氯化钠的溶解度受温度的影响不大,故可以用蒸发结晶的方法,来制取粗盐。
粗盐溶于水,过滤后得到的溶液中含有MgSO4、CaCl2、NaCl,先向混合溶液中加入过量的Ba(OH)2溶液,此时得到的混合物为:Mg(OH)2沉淀、BaSO4沉淀和Ba(OH)2、CaCl2、NaCl溶液,再向其中加过量的Na2CO3溶液,此时得到的混合物为:BaCO3沉淀、CaCO3沉淀和NaOH、NaCl、Na2CO3,此混合物经过滤后得到NaOH、NaCl和Na2CO3的混合溶液,此时加入适量的盐酸,即可得到较纯净的氯化钠溶液,最后蒸发提取氯化钠即可。
(3)根据氨碱法制纯碱可知:精制盐(NaCl)制成饱和溶液后通入氨气达到饱和,再通入二氧化碳,同时继续通入NH3,等析出大量沉淀后过滤,遂得到NaHCO3,灼烧NaHCO3可得到Na2CO3。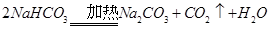 。
。
(4)为了使MgCl2转化为Mg(OH)2,可以加入碱液,考虑到经济原因,可加入较便宜的熟石灰,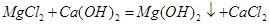 ,过滤即可分离。至于溶解氯化镁,可加稀盐酸适量,
,过滤即可分离。至于溶解氯化镁,可加稀盐酸适量,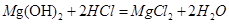
(1)海水淡化的方法主要是将杂质除去,将水提炼出来即可,例如多级闪急蒸馏法、蒸馏法、结晶法等。
(2)氯化钠的溶解度受温度的影响不大,故可以用蒸发结晶的方法,来制取粗盐。
粗盐溶于水,过滤后得到的溶液中含有MgSO4、CaCl2、NaCl,先向混合溶液中加入过量的Ba(OH)2溶液,此时得到的混合物为:Mg(OH)2沉淀、BaSO4沉淀和Ba(OH)2、CaCl2、NaCl溶液,再向其中加过量的Na2CO3溶液,此时得到的混合物为:BaCO3沉淀、CaCO3沉淀和NaOH、NaCl、Na2CO3,此混合物经过滤后得到NaOH、NaCl和Na2CO3的混合溶液,此时加入适量的盐酸,即可得到较纯净的氯化钠溶液,最后蒸发提取氯化钠即可。
(3)根据氨碱法制纯碱可知:精制盐(NaCl)制成饱和溶液后通入氨气达到饱和,再通入二氧化碳,同时继续通入NH3,等析出大量沉淀后过滤,遂得到NaHCO3,灼烧NaHCO3可得到Na2CO3。
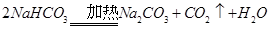 。
。(4)为了使MgCl2转化为Mg(OH)2,可以加入碱液,考虑到经济原因,可加入较便宜的熟石灰,
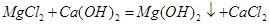 ,过滤即可分离。至于溶解氯化镁,可加稀盐酸适量,
,过滤即可分离。至于溶解氯化镁,可加稀盐酸适量,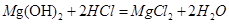

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目