题目内容
【题目】纯碱(Na2CO3)是一种重要的有机化工原料。侯氏制碱法制出的纯碱常含少量NaCl杂质,化学兴趣小组对工业纯碱样品进行实验探究。
I研究Na2CO3的性质
(1 Na2CO3溶液显_________(填“酸性”、“中性”或“碱性”)。
(2)检验样品中碳酸根的方法是__________________。
Ⅱ设计以下实验方案,测定样品中Na2CO3的质量分数。
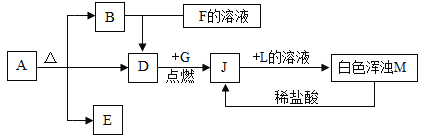
[方案一]取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________。
(4)实验中判断沉淀是否完全的方法是____________
[方案二]采用图装置,检查装置气密性;称取样品m1g于锥形瓶中,称装置D质量为m2g;关闭止水夹c,打开止水夹a、b,缓慢鼓入空气数分钟,关闭止水夹a、b,打开止水夹c,缓慢加入稀硫酸至不再产生气体为止;打开止水夹a,缓慢鼓入空气数分钟,再称量装置D质量为m3g。
(查阅资料)浓硫酸具有吸水性,碱石灰的成分为CaO和NaOH固体。
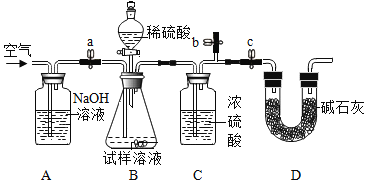
(5)装置B中发生的化学方程式为_________。
(6)样品中Na2CO3的质量分数的计算式是________。
(7)该测定结果比实际值偏高,从装置上分析其原因可能是_____________,改进措施为_____________。
【答案】碱性 取少量样品于试管中,向试管中滴加适量稀盐酸,振荡;将生成的气体通入澄清石灰水,若石灰水变浑浊,则证明样品中有碳酸根 玻璃棒 滴加Ba(OH)2溶液,若不再产生沉淀,则证明沉淀完全;反之,则沉淀未完全 ![]()
![]() ×100% 装置D右侧外界空气中的二氧化碳和水蒸气被装置D吸收(合理即可) 装置D右侧再增加一个装着碱石灰的干燥管
×100% 装置D右侧外界空气中的二氧化碳和水蒸气被装置D吸收(合理即可) 装置D右侧再增加一个装着碱石灰的干燥管
【解析】
(1)Na2CO3俗名为纯碱,其水溶液显碱性;
故填:碱性。
(2)碳酸根离子与氢离子结合生成水和二氧化碳,检验方法为取少量样品于试管中,向试管中滴加适量稀盐酸,振荡,将生成的气体通入澄清石灰水,若石灰水变浑浊,则证明样品中有碳酸根;
故填:取少量样品于试管中,向试管中滴加适量稀盐酸,振荡,将生成的气体通入澄清石灰水,若石灰水变浑浊,则证明样品中有碳酸根。
(3)过滤操作所用的玻璃仪器为:烧杯、漏斗、玻璃棒;
故填:玻璃棒。
(4)判断沉淀是否完全的方法为:滴加Ba(OH)2溶液,若不再产生沉淀,则证明溶液中碳酸根反应完全;反之,则碳酸根未完全反应;
故填:滴加Ba(OH)2溶液,若不再产生沉淀,则证明沉淀完全;反之,则沉淀未完全。
(5)Na2CO3溶液与稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式是![]() ;
;
故填:![]() 。
。
(6)分析实验方案可知:第一次缓慢鼓入空气数分钟,可排除装置内空气,防止装置D吸收空气中的二氧化碳产生测量误差;缓慢加入足量稀硫酸与样品中碳酸钠充分反应生成CO2,导出的气体中含有二氧化碳与水蒸气,装置C中浓硫酸的作用是吸水,利用装置D中碱石灰中的CaO和NaOH固体吸收装置B产生的CO2,第二次缓慢鼓入空气数分钟,目的是赶气,保证产生的CO2全部被装置D吸收。
装置D前后两次测量的质量差(m3-m2)g为装置B产生的CO2质量。根据化学方程式的计算可得m(Na2CO3);
设碳酸钠的质量为x
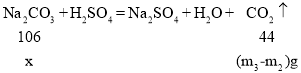
![]()
x=![]()
样品中Na2CO3的质量分数=![]() =
=![]() ;
;
故填:![]()
(7)从装置上分析若装置D右侧没有滤除空气中的二氧化碳和水蒸气的装置,装置D会吸收外界空气中的二氧化碳和水蒸气,使测定结果比实际值偏高;减少误差的措施可在装置D右侧再增加一个装着碱石灰的干燥管;
故填:装置D右侧外界空气中的二氧化碳和水蒸气被装置D吸收(合理即可) 装置D右侧再增加一个装着碱石灰的干燥管。

 53天天练系列答案
53天天练系列答案