��Ŀ����
����Ŀ��ijͬѧ������ͼװ��̽���������������ϵ�������ɷ֡�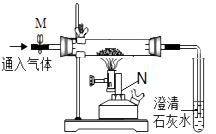
��1������ʶ������������N��֪�÷�Ӧ����������
��2�����������ϡ�������������ֻ��Fe3O4�ܱ�����������
ijЩ�������������ʱ����������Ӧ��
��������롿�������FeO��
�������Fe3O4��
�������FeO��Fe3O4����
��ʵ�鲽�衿
��������װ���������װ�õ������ԣ������ǣ��رյ��ɼ�M����
�ڳ�ȡ16.0g��������ĩ������Ϊm�����ۣ����Ȼ�Ϻ��벣���ܡ�
��ͨ��CO2 �� ���۲쵽��������ʱ�����ϵ��ɼ�M����ʼ���Ȳ����ܡ�
�ܵ�����ȫ���ʺ�ɫ��ֹͣ���ȣ������������к�ɫ��ĩ������ֽ�ϣ�ȡ�����μ�ϡ���ᣬ�����ݲ������ô�����������ĩ������������
��3����ʵ����ۡ�����������������������m�ķ�Χ����
��4�����������ۡ�ʵ���г���ʯ��ˮ����Ҫ��������
���𰸡�
��1������
��2��������ĩ�˷���ˮ��,˫�ֽ������������(���Ȳ�����),���ܿ�������ð��,����(ֹͣ����)��,���ܿ��γ�һ���ȶ�ˮ��,����ͨ������̼����ֱ����������ȴ
��3����,1.4g~5.6g
��4���жϲ������п����Ƿ����ž�
������������ʶ����������N�Ǿƾ���ƣ���֪�÷�Ӧ��Ҫ���£�
��ʵ�鲽�衿�ټ��װ�õ�������ʱ�����Թرյ��ɼ�M��������ĩ�˷���ˮ�У�˫�ֽ������������(���Ȳ�����)�����ܿ�������ð��������(ֹͣ����)���ܿ��γ�һ���ȶ�ˮ����˵�����������á���ʵ�����ǰ��Ϊ��ֹ���ȵ�������������Ӵ�������Ӧ��Ӧ����ͨ��ԭ�������壬ֱ����������ȴΪֹ��
��ʵ����ۡ����ɵĺ�ɫ��ĩ�ܱ�������ȫ������˵���������������ϵ�������ijɷ�ΪFeO��Fe3O4��
����������������ȫ��Ӧ����������������Ҫ��������Ϊa
Fe2O3+ | Fe |
160 | 56 |
16.0g | a |
![]() ��
��
a= 5.6g
�������ֻ����������������Ҫ����������Ϊb
4Fe2O3+ | Fe |
640 | 56 |
16.0g | b |
![]()
b=1.4g
����ɫ���岻�ܱ�����ȫ���������ҵμ�ϡ���ᣬ�����ݲ�����˵��ʣ������к�����������������û�������ʣ������������۵�������Χ��1.4g��5.6g��
���������ۡ�����̽��ʵ����ʹ��CO2�������ų�������������������ֹ���۱����������ã��Թ��еij����ʯ��ˮ����ǣ��жϲ������п����Ƿ����ž���
���Դ��ǣ����¡�������ĩ�˷���ˮ�У�˫�ֽ������������(���Ȳ�����)�����ܿ�������ð��������(ֹͣ����)���ܿ��γ�һ���ȶ�ˮ��������ͨ������̼����ֱ����������ȴ���ۡ�1.4g~5.6g���жϲ������п����Ƿ����ž���
�����㾫������������ұ�����������Ҫ�ɷֶ���Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ұ����ԭ�ϣ�����ʯ����̿��ʯ��ʯ������������������ʯ�д�������Ҫ�ɷ���Fe3O4 ������������Ҫ�ɷ���Fe2O3 ����������������ǣ�����O2��ˮ�Ӵ����������Ҫ�ɷ֣�Fe2O3XH2O����

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�