题目内容
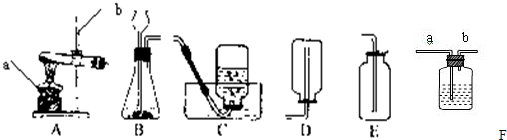
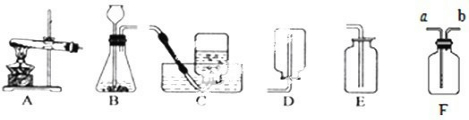
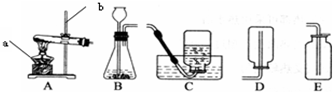
实验室常用下列装置来制取氧气: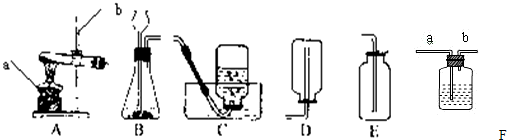
(1)写出图中有标号仪器的名称:a________、b________.
(2)用氯酸钾和二氧化锰来制取氧气时,可选用的发生装置是________(填序号),其中二氧化锰起________作用.发生反应的化学方程式为________.
(3)用E装置收集氧气的依据是________,检验氧气是否集满的方法是________
(4).如图F是某学生设计的一种有洗气、贮气等用途的装置.
当用排水集气法收集氢气时,瓶内先装满水,气体从________(填“a”或“b”,下同)处导管通入.若要用水将瓶中氢气排出使用,水应从________处导管进入.
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下NH3是一种无色、有刺激性气味的气体,密度比空气小.NH3极易溶于水.制取并收集NH3,应该从上图中选择的是________和________(填序号).
(6),某同学在用氯酸钾和二氧化锰为原料制取氧气时,反应前称的混合物的质量是197g,反应停止后,称得剩余固体质量是
149g,试计算混合物中二氧化锰的质量为多少?
解:(1)由图示可知标号仪器a是酒精灯,b是铁架台;
(2)实验室用氯酸钾和二氧化锰来制取氧气,属于加热固体制取氧气,反应装置应选A,其中二氧化锰起催化作用,反应的方程式是:2KClO3 2KCl+3O2↑;
2KCl+3O2↑;
(3)由于氧气的密度略大于空气的密度,所以可以用E装置向上排空气法收集氧气.由于氧气能支持燃烧,所以,验满的方法是:将带火星的木条置于集气瓶口,若木条复燃则证明收集满了;
(4)由于氢气的密度小于水的密度,当用排水集气法收集氢气时,瓶内先装满水,气体从b处导管通入.若要用水将瓶中氢气排出使用,水应从a处导管进入;
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,属于加热固体制取气体,应选用A装置作反应装置;由于NH3密度比空气小,极易溶于水,应选用D装置进行收集;
(6)解:根据质量守恒定律,生成氧气的质量为:197g-149g=48g;
设生成的氯化钾的质量为x,
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
x 48g
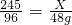 解得:X=122.5g
解得:X=122.5g
则混合物中二氧化锰的质量为:197g-122.5g=74.5g
故答为:(1)酒精灯,铁架台;(2)A,催化,2KClO3 2KCl+3O2↑;(3)氧气的密度略大于空气的密度,将带火星的木条置于集气瓶口,若木条复燃则证明收集满了;(4)b,a;(5)A,D;(6)混合物中二氧化锰的质量为74.5g.
2KCl+3O2↑;(3)氧气的密度略大于空气的密度,将带火星的木条置于集气瓶口,若木条复燃则证明收集满了;(4)b,a;(5)A,D;(6)混合物中二氧化锰的质量为74.5g.
分析:(1)熟悉常见仪器的名称和用途;
(2)根据实验室制用氯酸钾来制取氧气的反应物的状态和反应的条件确定发生装置,二氧化锰作催化剂,根据反应写出反应的方程式;
(3)根据E装置收集氧气的方法分析氧气性质,根据氧气能支持燃烧性质分析验满的方法;
(4)根据氢气和水的密度关系分析收集气体和排出气体时气体、水的入口;
(5)根据实验室制取氨气的反应物的状态和反应的条件确定发生装置,根据气体的收集方法确定收集装置;
(6)根据质量守恒定律可得,生成氧气的质量=反应前物质质量总和-反应后物质质量总和;然后根据氯酸钾分解的化学方程式和生成氧气的质量,列出比例式,就可计算出参加反应的氯酸钾的质量,再求出二氧化锰的质量.
点评:本题比较全面考查了实验室有关气体的制法,要想解答好这类题目时,首先,要熟记气体的实验室制取原理和气体的溶解性、密度等;还要熟悉常见仪器的用途、基本的实验操作及注意事项等等.
(2)实验室用氯酸钾和二氧化锰来制取氧气,属于加热固体制取氧气,反应装置应选A,其中二氧化锰起催化作用,反应的方程式是:2KClO3
 2KCl+3O2↑;
2KCl+3O2↑;(3)由于氧气的密度略大于空气的密度,所以可以用E装置向上排空气法收集氧气.由于氧气能支持燃烧,所以,验满的方法是:将带火星的木条置于集气瓶口,若木条复燃则证明收集满了;
(4)由于氢气的密度小于水的密度,当用排水集气法收集氢气时,瓶内先装满水,气体从b处导管通入.若要用水将瓶中氢气排出使用,水应从a处导管进入;
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,属于加热固体制取气体,应选用A装置作反应装置;由于NH3密度比空气小,极易溶于水,应选用D装置进行收集;
(6)解:根据质量守恒定律,生成氧气的质量为:197g-149g=48g;
设生成的氯化钾的质量为x,
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
x 48g
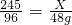 解得:X=122.5g
解得:X=122.5g则混合物中二氧化锰的质量为:197g-122.5g=74.5g
故答为:(1)酒精灯,铁架台;(2)A,催化,2KClO3
 2KCl+3O2↑;(3)氧气的密度略大于空气的密度,将带火星的木条置于集气瓶口,若木条复燃则证明收集满了;(4)b,a;(5)A,D;(6)混合物中二氧化锰的质量为74.5g.
2KCl+3O2↑;(3)氧气的密度略大于空气的密度,将带火星的木条置于集气瓶口,若木条复燃则证明收集满了;(4)b,a;(5)A,D;(6)混合物中二氧化锰的质量为74.5g.分析:(1)熟悉常见仪器的名称和用途;
(2)根据实验室制用氯酸钾来制取氧气的反应物的状态和反应的条件确定发生装置,二氧化锰作催化剂,根据反应写出反应的方程式;
(3)根据E装置收集氧气的方法分析氧气性质,根据氧气能支持燃烧性质分析验满的方法;
(4)根据氢气和水的密度关系分析收集气体和排出气体时气体、水的入口;
(5)根据实验室制取氨气的反应物的状态和反应的条件确定发生装置,根据气体的收集方法确定收集装置;
(6)根据质量守恒定律可得,生成氧气的质量=反应前物质质量总和-反应后物质质量总和;然后根据氯酸钾分解的化学方程式和生成氧气的质量,列出比例式,就可计算出参加反应的氯酸钾的质量,再求出二氧化锰的质量.
点评:本题比较全面考查了实验室有关气体的制法,要想解答好这类题目时,首先,要熟记气体的实验室制取原理和气体的溶解性、密度等;还要熟悉常见仪器的用途、基本的实验操作及注意事项等等.

练习册系列答案
相关题目
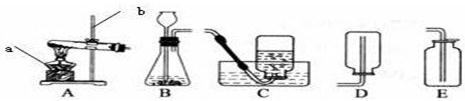

 实验室常用下列装置来制取氧气:
实验室常用下列装置来制取氧气: