题目内容
【题目】超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中的Na2CO3的质量分数。他们取了纯碱样品11.0g,利用右下图装置进行实验测定。数据记录如下:
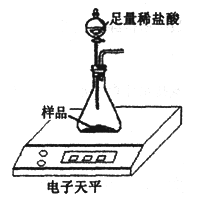
|
计算:
①反应生成CO2的质量为________g;
②通过计算确定该品牌纯碱中Na2CO3的质量分数。_____(写出计算过程,计算结果精确至0.1%。)
③如果测得的结果比实际纯度高,可能的原因是_______________(答一种即可)。
【答案】 4.4g 设参加反应的碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+CO2↑+H2O(1分)
106 44
x 4.4g
106/44=x/4.4g (1分)
则解得x=10.6g(1分)
则食用纯碱中碳酸钠的质量分数为:10.6g/11.0g×100% ≈96.4%
答:该品牌纯碱中Na2CO3的质量分数为96.4%。 稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大(或水蒸气随CO2气体排出,从而导致所测纯度偏大)。
【解析】(1).据质量守恒定律可知,反应前后物质的总质量不变,所以二氧化碳的质量为11.0g+160g-166.6g= 4.4g (2). 设参加反应的碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+CO2↑+H2O(1分)
106 44
x 4.4g
106/44=x/4.4g (1分)
则解得x=10.6g(1分)
则食用纯碱中碳酸钠的质量分数为:10.6g/11.0g×100% ≈96.4%
答:该品牌纯碱中Na2CO3的质量分数为96.4%。 (3). 稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大(或水蒸气随CO2气体排出,从而导致所测纯度偏大)。