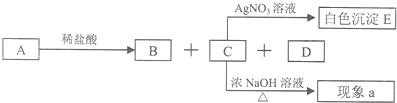
题目内容
(2010?昆明)(1)葡萄糖的化学式为C6H12O6,按下列要求进行计算:①葡萄糖中碳、氢、氧三种元素的质量比为______;
②葡萄糖的相对分子质量为______;
③葡萄糖中碳元素的质量分数为______.
(2)蒸馒头用的某纯碱中含有少量的氯化钠,为了测定该纯碱中碳酸钠和氯化钠的含量,
取一定量的该纯碱样品全部溶解在100g水中,再加入氯化钙溶液141g,恰好完全反应.
(反应方程式为Na2CO3+CaCl2═CaC03↓+2NaCl)经过滤、干燥后称得沉淀质量为10g,所得滤液中氯化钠的质量分数为5%.请计算:
①纯碱样品中碳酸钠的质量;
②纯碱样品中氯化钠的质量.
【答案】分析:(1)根据葡萄糖的化学式为C6H12O6,利用组成元素质量比、质量分数、相对分子质量的计算方法,完成关于化学式的计算;
(2)根据反应的化学方程式,由生成沉淀的质量10g计算样品中碳酸钠的质量;所得质量分数5%的溶液中的氯化钠减去反应所生成的氯化钠即纯碱样品中氯化钠的质量,5%的溶液中的氯化钠的质量可利用质量分数5%及溶液中溶剂水的质量计算出来.
解答:解:(1)①葡萄糖中C6H12O6碳、氢、氧三种元素的质量比=(12×6):(1×12):(16×6)=6:1:8;
②葡萄糖C6H12O6的相对分子质量=12×6+1×12+16×6=180;
③葡萄糖中C6H12O6碳元素的质量分数= ×100%=40%
×100%=40%
故答案为:6:1:8;180;40%;
(2)设碳酸钠的质量为x,反应生成氯化钠的质量为y,氯化钙的质量为z
Na2CO3+CaCl2═CaC03↓+2NaCl
106 111 100 117
x z 10g y
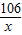 =
= x=10.6g
x=10.6g
 =
= y=11.7g
y=11.7g
 =
= z=11.1g
z=11.1g
则恰好完全反应后所得滤液中水的质量=100g+(141g-11.1g)=229.9g,则滤液中氯化钠的质量= ×229.9g=12.1g
×229.9g=12.1g
纯碱样品中氯化钠的质量=12.1g-11.7g=0.4g
答:①纯碱样品中碳酸钠的质量为10.6g;②纯碱样品中氯化钠的质量为0.4g.
点评:根据化学方程式可以表示反应中各物质的质量关系,由其中任意一种物质的质量可计算反应中其它物质的质量.
(2)根据反应的化学方程式,由生成沉淀的质量10g计算样品中碳酸钠的质量;所得质量分数5%的溶液中的氯化钠减去反应所生成的氯化钠即纯碱样品中氯化钠的质量,5%的溶液中的氯化钠的质量可利用质量分数5%及溶液中溶剂水的质量计算出来.
解答:解:(1)①葡萄糖中C6H12O6碳、氢、氧三种元素的质量比=(12×6):(1×12):(16×6)=6:1:8;
②葡萄糖C6H12O6的相对分子质量=12×6+1×12+16×6=180;
③葡萄糖中C6H12O6碳元素的质量分数=
 ×100%=40%
×100%=40%故答案为:6:1:8;180;40%;
(2)设碳酸钠的质量为x,反应生成氯化钠的质量为y,氯化钙的质量为z
Na2CO3+CaCl2═CaC03↓+2NaCl
106 111 100 117
x z 10g y
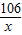 =
= x=10.6g
x=10.6g =
= y=11.7g
y=11.7g =
= z=11.1g
z=11.1g则恰好完全反应后所得滤液中水的质量=100g+(141g-11.1g)=229.9g,则滤液中氯化钠的质量=
 ×229.9g=12.1g
×229.9g=12.1g纯碱样品中氯化钠的质量=12.1g-11.7g=0.4g
答:①纯碱样品中碳酸钠的质量为10.6g;②纯碱样品中氯化钠的质量为0.4g.
点评:根据化学方程式可以表示反应中各物质的质量关系,由其中任意一种物质的质量可计算反应中其它物质的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
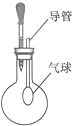 (2010?昆明)(1)使用如图装置进行实验时,若圆底烧瓶中装有HCl气体,将滴管中的溶液滴加到圆底烧瓶中,发现气球鼓起来.则滴管中的物质除碱性溶液外还可能是
(2010?昆明)(1)使用如图装置进行实验时,若圆底烧瓶中装有HCl气体,将滴管中的溶液滴加到圆底烧瓶中,发现气球鼓起来.则滴管中的物质除碱性溶液外还可能是