题目内容
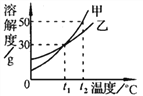
【题目】如图是a、b、c三种固体物质的溶解度曲线。据图回答下列问题。
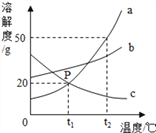
(1)P点表示的含义是_____________________。
(2)将相同质量t2℃时的a、b、c饱和溶液的温度降低到t1℃时,析出晶体最多的是______。
(3)将t1℃时的a、b、c饱和溶液的温度升高到t2℃时,溶质质量分数由小到大的顺序是_________。
(4)t2℃时,将40g a物质放入盛有50g水的烧杯中,所得溶液溶质质量分数为___________。
(5)当a中混有少量b时,可采用______________的方法提纯a。
【答案】 t1℃时,a、c溶解度相等为20g a c<a=b 33.3% 降温结晶
【解析】(1)P点表示的含义是在t1℃时,a、c溶解度相等为20g。(2)c的溶解度随温度降低而增大,降温时,变为不饱和溶液,无晶体析出,a、c的溶解度随温度降低而减小,其中a的溶解度受温度影响较大,降温时析出的晶体多。故将相同质量t2℃时的a、b、c饱和溶液的温度降低到t1℃时,析出晶体最多的是a。(3)温度升高到t2℃时,a、b的溶解度增大,溶质质量分数不变,c的溶解度减小,溶质质量分数减小,故将t1℃时的a、b、c饱和溶液的温度升高到t2℃时,溶质质量分数由小到大的顺序是c<a=b。(4)t2℃时,a的溶解度是50g,即该温度时,100g水中最多能溶解50ga,则50g水最多能溶解25ga,所得溶液溶质质量分数为:![]() ×100%=33.3%。(5)a的溶解度受温度影响较大,对于受温度影响较大的物质用降温结晶的方法提纯。
×100%=33.3%。(5)a的溶解度受温度影响较大,对于受温度影响较大的物质用降温结晶的方法提纯。

【题目】(10分)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
(1)氢氧化钠固体要密封保存,原因有:
① ;② 。
【对固体猜想】
猜想一:全部是NaOH;猜想二:全部是Na2CO3;猜想三:是NaOH和Na2CO3混合物
【实验和推断】(2)为进一步确定成分,进行了以下探究:
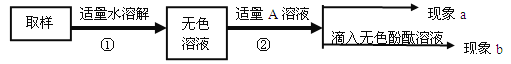
对无色溶液进行以下实验:
实验操作 | 实验现象 | 实验结论 |
第一步: 用试管取约2mL该溶液,滴入适量氢氧化钙溶液,振荡。 | 现象a:白色沉淀 | 化学方程式: ① , 有碳酸钠并全部除尽。 |
第二步: 静置,取上层清液于试管中滴入酚酞溶液,振荡。 | 现象b: ② | 含有NaOH,猜想三成立,是NaOH和Na2CO3混合物 |
③分析:小组中有同学提出质疑,认为以上实验不能证明猜想三成立,理由是:
。
④反思:把第一步中的氢氧化钙溶液换成 溶液,可达到实验目的。
(3)请利用以下提供的试剂,设计实验证明猜想一是正确的,即氢氧化钠没有变质。
提供的试剂有:酚酞溶液、稀盐酸、氢氧化钡溶液、氯化钡溶液
实验操作 | 实验现象 | 实验结论 |