题目内容
【题目】海水晒制粗盐的主要成分为NaCl,还含有少量的MgCl2、CaCl2、MgSO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:
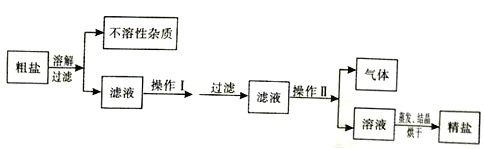
请分析上面流程图示,回答:
(1)为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作I中依次加入的物质(过量)和顺序,合理的是_______;
A.NaOH、BaCl2、Na2CO3 B.Ba(NO3)2、Na2CO3、NaOH
C.Na2CO3、BaCl2、NaOH D.BaCl2、NaOH、Na2CO3
(2)操作I过量加入各物质的目的是_________;
(3)为获取较纯净精盐,操作II的具体方法是______________。
【答案】AD 过量的氢氧化钠为了除尽镁离子,过量的氯化钡为了除尽硫酸根离子,过量的碳酸钠为了除尽钡离子和钙离子 加入过量的稀盐酸除去氢氧化钠和碳酸钠
【解析】
(1)A中先加入过量的氢氧化钠,可以除去镁离子,反应后溶液中有有氢氧化钠、氯化钙、硫酸钠和氯化钠,在加入过量的氯化钡,可以除去硫酸根离子,反应后溶液中有氢氧化钠,、氯化钙、氯化钡和氯化钠,最后加入碳酸钠,可以除去钙离子和钡离子,最终反应后溶液中有氯化钠,氢氧化钠,碳酸钠,故操作2中可以加入稀盐酸,除去过量的氢氧化钠和碳酸钠,故A正确;B中最终有硝酸根离子,故错误;C中过量的氯化钡不能出尽,故错误;D先加入过量的氯化钡将硫酸根除去,再加入过量的氢氧化钠去除镁离子,再加入过量的碳酸钠除去剩余的钡离子和原有的钙离子,故可以去除。故选AD。
(2)过量的氢氧化钠为了除尽镁离子,过量的氯化钡为了除尽硫酸根离子,过量的碳酸钠为了除尽钡离子和钙离子。
(3)操作1后的溶液中含有过量的氢氧化钠和碳酸钠,故加入过量的稀盐酸除去氢氧化钠和碳酸钠。

练习册系列答案
相关题目