题目内容
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
| ||
| ||
(2)实验①的目的是
实验中滴加FeCl3溶液的目的是
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是
(5)催化剂是化学反应前后
(6)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
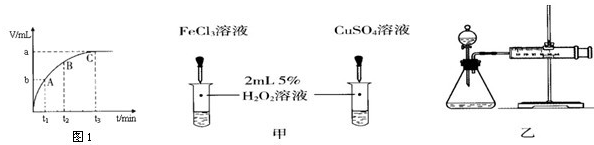
①定性分析:如图甲可通过观察
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是
(2)根据试管A、B实验操作的异同点解答实验目的;
(3)根据影响化学反应速率的外界因素解答;
(4)根据速率的表示方法和图象横坐标和纵坐标的意义解答;
(5)根据催化剂的定义分析;
(6)至于定性分析可以根据产生气泡的速率来进行判断反应的快慢;在探究类似的影响反应速率的快慢的因素时通常采取控制变量法来进行实验,选择合适的物质;
若定量分析反应的快慢可以收集一定体积的气体,时间短则反应快,可以据此解答.
| ||
(2)分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现,说明过氧化氢分解能发生,试管A、B中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中,两支试管不同点是试管A的温度比试管B的温度低,说明研究的是温度对反应速率的影响,而开始加滴加FeCl3溶液,目的加快H2O2分解,使实验现象易于观察;
(3)影响化学反应速率的外界因素有浓度、温度、气体的压强、催化剂、固体的表面积,另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液,试管A、B中均未见气泡产生,为加快反应速率,可从温度或催化剂的影响角度考虑,如:将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴等浓度的 FeCl3溶液,观察产生气泡的速率;
(4)该图象横坐标表示时间,纵坐标表示生成气体的体积,时间越短生成的气体越多,反应速率越快,所以速率最慢的为C;
(5)催化剂是改变反应的速率,而在化学反应前后其质量和化学性质都没有发生改变;
(6))①至于定性分析可以根据产生气泡的速率来进行判断反应的快慢;为比较Fe3+和Cu2+对H2O2分解的催化效果,要保持其它条件相同,而FeCl3溶液中还有氯离子,CuSO4中含有铜离子,因此氯离子可能也会影响反应速率,产生干扰,所以可将将FeCl3改为Fe2(SO4)3;
②若定量分析反应的快慢可以测定收集40mL的气体所需的时间,时间短则反应快;
故答案为:(1)2H2O2
| ||
(2)研究温度对H2O2分解速率的影响 加快H2O2分解速率,使实验现象易于观察;
(3)将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴等浓度FeCl3溶液,观察产生气泡的速率;
(4)C点的速率;
(5)质量和化学性质;
(6)①溶液中气泡产生的速率; Fe2(SO4)3;排除氯离子的干扰(合理即可);
②收集40mL气体所需的时间.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答
|
编号 |
操作 |
实验现象 |
|
① |
分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. |
试管A中不再产生气泡;试管B中产生的气泡量增大. |
|
② |
另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生. |
(1)过氧化氢分解的化学方程式为 .
(2)实验①的目的是 .
实验中滴加FeCl3溶液的目的是 .
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是 (用实验中提供的试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是 .
(5)催化剂是化学反应前后 均未改变的一类化学物质.
(6)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察 ,定性比较得出结论.有同学提出将FeCl3改为 更为合理,其理由是 .
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是 .
(8分)为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验。
|
实验编号 |
实验操作 |
实验现象 |
|
① |
分别在试管A、B中加入 5 mL 5%(溶液浓度) H2O2溶液,各滴入2 滴相同浓度的CuSO4溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
|
② |
另取两支试管分别加入5mL 5%H2O2溶液和5 mL 10%H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是 。
实验中滴加CuSO4溶液的目的是 。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你设计的实验方案是 。(用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Fe2(SO4)3溶液也有一定的催化作用。为比较Fe2(SO4)3和CuSO4溶液对H2O2分解的催化效果。某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

如图所示,同学们分别从定性和定量角度进行了比较。
①定性分析:如图甲可通过观察 ,定性比较得出结论。
②定量分析:用图乙所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是______.
实验中滴加FeCl3溶液的目的是______.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______(用实验中提供的试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是______.
(5)催化剂是化学反应前后______ 均未改变的一类化学物质.
(6)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察______,定性比较得出结论.有同学提出将FeCl3改为______更为合理,其理由是______.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是______.
